题目内容
小青同学为了制作叶脉书签,打算配制125g 10%的NaOH溶液。
⑴计算小青需要称取NaOH的质量 。
⑵小青取上述适量溶液,将洗净的树叶放在溶液中煮沸后取出,清洗烘干。为了测定剩下的100gNaOH溶液中的溶质NaOH的质量分数,小青向该溶液中逐渐加入7.3%的稀盐酸,当溶液pH=7时,消耗盐酸50g。计算剩下的100gNaOH溶液中NaOH的质量分数。
⑴计算小青需要称取NaOH的质量 。
⑵小青取上述适量溶液,将洗净的树叶放在溶液中煮沸后取出,清洗烘干。为了测定剩下的100gNaOH溶液中的溶质NaOH的质量分数,小青向该溶液中逐渐加入7.3%的稀盐酸,当溶液pH=7时,消耗盐酸50g。计算剩下的100gNaOH溶液中NaOH的质量分数。
(l)12.5 g(2分) ⑵4%(4分)
试题分析:(1)根据溶质质量分数计算公式可知,溶液中溶质质量=溶液质量×溶液的溶质质量分数,故125g10%的NaOH溶液中所含溶质氢氧化钠的质量= 125g×10%=12.5g;
(2)根据氢氧化钠与盐酸的反应,书写化学方程式,再由加入盐酸中HCl的质量,计算反应的氢氧化钠的质量,利用氢氧化钠与剩下溶液的质量比,即可计算剩下溶液中NaOH的质量分数。
解,设参加反应的氢氧化钠的质量为x
NaOH + HCl =" NaCl" + H2O
40 36.5
x 50g×7.3%
40:36.5="x:(50g×7.3%)"
解得,x=4g
则剩下的氢氧化钠的质量分数=
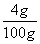 ×100%=4%
×100%=4%答:(1)小青需要称取NaOH的质量为12.5g;(2)剩下的氢氧化钠溶液中NaOH的质量分数为4%。
点评:本题为根据化学方程式计算类问题中的简单计算,完整的计算步骤、规范的书写格式,是解答此类问题的关键;此外,还要注意:根据化学方程式进行计算时,所用物质质量均为参加反应的纯净物的质量,如不要把稀盐酸质量50g当作HCl质量代入计算。

练习册系列答案
相关题目