题目内容
维生素C是一种人体必需的维生素。查阅资料可知下列信息:
请参与下列问题的讨论。
(1)维生素C中碳、氢、氧三种元素的质量比为 。
(2)某兴趣小组的同学对维生素C的还原性进行实验探究,其实验结果如下图所示。
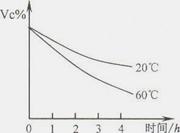
实验说明了维生素C在空气中氧化除跟氧气有关外,还与 有关。因此,生吃新鲜蔬菜要比熟吃蔬菜维生素C的损失 (选填“大”或“小”)。
(3)①该兴趣小组同学对某果计饮料中维生素C的含量进行测定,反应原理为:
C6H8O6 + I2 ="=" C6H6O6 + 2HI
实验步骤如下:
a.取果汁饮料10 mL,用煮沸并冷却的蒸馏水稀释到50 mL;
b.加醋酸溶液酸化;
c.加人少量指示剂;
d.逐滴加人稀碘水至完全反应,实验测得恰好反应时,消耗溶质碘的质量为25.4mg。计算该果汁饮料每100mL中含维生素C的质量为________mg。
②有些同学在测定时,未加人醋酸溶液酸化,测得维生素C的含量明显小于其他同学。其原因是 。
| | 部分性质 | 生理作用 |
| 维生素C 化学式:C6H806 | 无色晶体,易溶于水;在酸性溶液中稳定,中性或碱性溶液中易被空气氧化…… | 促进人体生长发育,增强人体对疾病的抵抗能力…… |
(1)维生素C中碳、氢、氧三种元素的质量比为 。
(2)某兴趣小组的同学对维生素C的还原性进行实验探究,其实验结果如下图所示。

实验说明了维生素C在空气中氧化除跟氧气有关外,还与 有关。因此,生吃新鲜蔬菜要比熟吃蔬菜维生素C的损失 (选填“大”或“小”)。
(3)①该兴趣小组同学对某果计饮料中维生素C的含量进行测定,反应原理为:
C6H8O6 + I2 ="=" C6H6O6 + 2HI
实验步骤如下:
a.取果汁饮料10 mL,用煮沸并冷却的蒸馏水稀释到50 mL;
b.加醋酸溶液酸化;
c.加人少量指示剂;
d.逐滴加人稀碘水至完全反应,实验测得恰好反应时,消耗溶质碘的质量为25.4mg。计算该果汁饮料每100mL中含维生素C的质量为________mg。
②有些同学在测定时,未加人醋酸溶液酸化,测得维生素C的含量明显小于其他同学。其原因是 。
(1)9:l:12 (2)温度 小
(3)①176mg ②被氧化的维生素C增多
(3)①176mg ②被氧化的维生素C增多
试题分析:(1)根据化合物中,元素的质量比=相对原子质量与相应原子个数的乘积的比,可知维生素C中碳、氢、氧三种元素的质量比=(12×6):8:(16×6)=9:l:12。
(2)根据维生素C随温度变化的图示可知,维生素C在空气中氧化除跟氧气有关外,还与温度有关(温度越高,VC含量越少),故生吃新鲜蔬菜要比熟吃蔬菜维生素C的损失小。
(3)①解,设l0ml果汁饮料中含维生素C的质量为x
C6H8O6 + I2 = C6H6O6 + 2HI
176 254
x 25.4mg
176:254 =x:25.4mg
解得,x="17.6mg"
则该果汁饮料每100mL中含维生素C的质量为=17.6mgxl0=176mg。
②根据表格中维生素C的性质,“在酸性溶液中稳定,中性或碱性溶液中易被空气氧化”,可知未加入醋酸溶液酸化时,被氧化的维生素C增多,故含量明显小于其他同学。
点评:本题主要考查学生运用化学方程式进行计算及分析题中信息进行解题的能力,计算本身难度不大,解答时注意要有完整的计算步骤和规范的书写格式。

练习册系列答案
相关题目
 2NaOH+ Cl2↑+ H2↑。现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?
2NaOH+ Cl2↑+ H2↑。现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?