题目内容
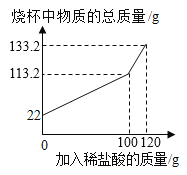
【题目】烧杯中盛有一定质量的氧化镁和氧化铁的固体混合物,向其中加入稀盐酸100g,恰好完全反应,得到该温度下的不饱和溶液120g。再向其中加入足量氢氧化钠溶液,充分反应后过滤,将沉淀洗涤、干燥、称量,其质量比原固体混合物增加了7.2g。则下列相关计算中,正确的是( )
A.原固体中金属元素质量为13.6g
B.所用稀盐酸的溶质质量分数为14.6%
C.最终所得溶液中含有NaCl的质量为58.5g
D.实验中消耗的氢氧化钠质量为32g
【答案】AD
【解析】
A、加入100g稀盐酸反应得到120g不饱和溶液可知,加入的金属氧化物的混合物为20g,将沉淀洗涤、干燥、称量,其质量比原固体混合物增加了7.2g,说明增加的O、H元素的质量为7.2g,与金属氧化物反应的氢离子和与氢氧根离子反应的氢离子质量相等,7.2g水中含有氧元素的质量为:7.2g×![]() =6.4g;原固体中金属元素质量为:20g-6.4g=13.6g,选项A正确;
=6.4g;原固体中金属元素质量为:20g-6.4g=13.6g,选项A正确;
B、设稀盐酸的溶质质量分数为x,根据氢元素质量守恒,
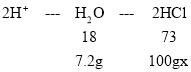
![]() x=29.2%,加入稀盐酸的溶质质量分数为29.2%,选项B错误;
x=29.2%,加入稀盐酸的溶质质量分数为29.2%,选项B错误;
C、由元素质量守恒可知,最终所得溶液中含有NaCl的质量为:100g×29.2%×![]() ×100%÷(
×100%÷(![]() )=46.8g,选项 C错误;
)=46.8g,选项 C错误;
D、设消耗的氢氧化钠质量为y,

![]() y=32g,选项D正确。故选AD。
y=32g,选项D正确。故选AD。

练习册系列答案
相关题目