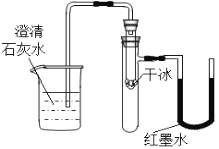
题目内容
【题目】实验室有氯化钾样品,其中含有少量的![]() 、
、![]() 、
、![]() 等杂质,将其进行精制的流程如下图:
等杂质,将其进行精制的流程如下图:
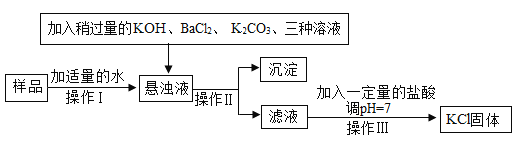
(1)流程图中KOH不可以用![]() 代替的原因是什么______?
代替的原因是什么______?
(2)流程图中沉淀的成分有多种,写出生成沉淀的化学方程式(写一个即可)___。
(3)在操作Ⅲ中玻璃棒的作用是什么 ______ ?
【答案】使用![]() 会引入新的杂质氯化钠(钠离子)
会引入新的杂质氯化钠(钠离子) ![]() 搅拌,防止局部温度过高造成液滴飞溅
搅拌,防止局部温度过高造成液滴飞溅
【解析】
氢氧化钾和氯化镁反应生成氢氧化镁和氯化钾,碳酸钾和氯化钡反应生成硫酸钡和氯化钾,盐酸和碳酸钾反应生成氯化钾、水和二氧化碳。
(1)实验提纯氯化钾,不能引入新的杂质,故流程图中KOH不可以用![]() 代替的原因是使用
代替的原因是使用![]() 会引入新的杂质氯化钠(钠离子)。
会引入新的杂质氯化钠(钠离子)。
(2)氢氧化钾和氯化镁反应生成氢氧化镁和氯化钾,流程图中生成沉淀的化学方程式![]() 。
。
(3)操作Ⅲ是蒸发结晶,玻璃棒的作用是搅拌,防止局部温度过高造成液滴飞溅。

【题目】NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)10℃时,在100 g水里溶解_________g KNO3时,溶液恰好达到饱和状态。
(2)右图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
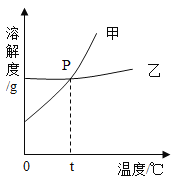
A.10℃~20℃ B.20℃~30℃
C.30℃~40℃ D.40℃~50℃
(3)10℃时,分别在100 g水中加入35 g NaCl 和KNO3固体,加热到60℃时,NaCl溶液为__________(填“饱和”或“不饱和”)溶液。加热前后,有关两溶液的说法正确的是____________(填字母序号)。
A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变