题目内容
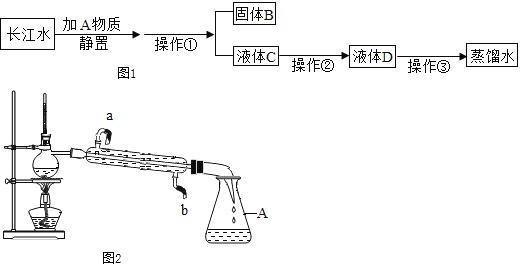
【题目】在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.
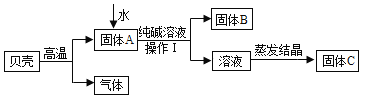
(1)贝壳高温煅烧时,发生反应的化学方程式是:______________________________;
(2)操作Ⅰ的名称是___________________;
(3)该流程中没有涉及的基本反应类型是___________________;
(4)固体B的化学式为_________________;
(问题与发现)
该小组同学所得到固体C一定是纯净的![]() 吗?
吗?
(猜想与假设)
根据反应原理,甲.乙.丙三位同学提出以下猜想:
甲:纯净的![]() ;
;
乙: ![]() 和
和![]() 的混合物;
的混合物;
丙: ![]() 和
和![]() 的混合物
的混合物
(探究与验证)甲.乙.丙三位同学分别设计下列方案,对自己的猜想进行验证实验操作.现象和结论如下表,请参与他们的探究并完成所缺内容
实验操作 | 现象 | 结论 | |
甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液; | 溶液变红 | 猜想成立 |
乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量_________; | 无气泡产生 | 猜想不成立 |
丙溶液 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和的M | __________ | 猜想成立 |
(1)丙同学实验中滴加的M溶液可能是______________,写出该反应的化学方程式_________________
(2)乙、丙同学认为甲同学的实验方案不正确,其理由是____________________________
【答案】 过滤 置换反应
过滤 置换反应 ![]() 稀盐酸 产生白色沉淀 碳酸钠溶液
稀盐酸 产生白色沉淀 碳酸钠溶液 ![]() 若含有碳酸钠或氢氧化钙,溶于水后溶液呈碱性,滴加酚酞溶液,溶液会变红,根据滴加酚酞后溶液呈红色不能说明是纯净的氢氧化钠
若含有碳酸钠或氢氧化钙,溶于水后溶液呈碱性,滴加酚酞溶液,溶液会变红,根据滴加酚酞后溶液呈红色不能说明是纯净的氢氧化钠
【解析】
如图所示,贝壳中的主要成分碳酸钙在高温下分解生成二氧化碳和氧化钙,该反应为分解反应;固体A中的氧化钙与水反应生成氢氧化钙,该反应为化合反应;氢氧化钙与纯碱溶液反应生成碳酸钙沉淀和氢氧化钠,该反应为复分解反应;经过操作I过滤得到固体B和溶液,溶液蒸发结晶得到固体C。
1、 (1)贝壳高温煅烧时,碳酸钙在高温下分解生成二氧化碳和氧化钙,反应的化学方程式是 ;
;
(2)操作Ⅰ实现固体和液体分离,操作的名称是过滤;
(3)该流程中涉及了分解反应、化合反应和复分解反应,没有涉及的基本反应类型是置换反应;
(4)固体B为碳酸钙,化学式为![]() 。
。
2、根据乙的现象和结论逆推实验操作,乙是为了验证有碳酸钠
乙的实验操作:取少量固体C,溶于适量水形成溶液后,滴加足量稀盐酸
现象:无气泡产生
结论:猜想不成立
丙是为了验证是![]() 和
和![]() 的混合物,即验证存在
的混合物,即验证存在![]() ,取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液,碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀和水,通过现象产生白色沉淀来得出结论猜想成立。
,取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液,碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀和水,通过现象产生白色沉淀来得出结论猜想成立。
(1)丙同学实验中滴加的M溶液可能是碳酸钠溶液,该反应的化学方程式为![]()
(2)乙、丙同学认为甲同学的实验方案不正确,其理由是若含有碳酸钠或氢氧化钙,溶于水后溶液呈碱性,滴加酚酞溶液,溶液会变红,根据滴加酚酞后溶液呈红色不能说明是纯净的氢氧化钠

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案【题目】下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是( )
选项 | 实验目的 | 实验过程 |
① | 证明变质 | 取少量溶液,滴加足量盐酸,将生成的气体通入澄清石灰水 |
② | 确定成分 | 取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
③ | 测定纯度 | 取一定量溶液,加入盐酸,用氢氧化钠固体吸收生成的气体,称量 |
④ | 除去杂质 | 取溶液,滴加石灰水至恰好完全反应,过滤 |
A.②③B.①③C.②④D.①④
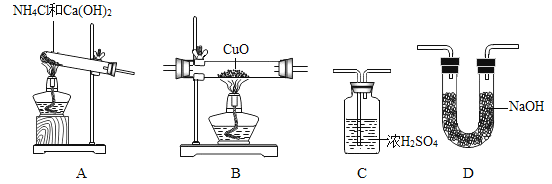
【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究,请你参与。
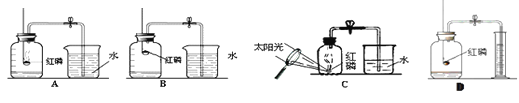
《设计实验》第一小组同学共同设计了如上图的A、B两套装置。
你认为合理的是(填编号)_______。
《进行实验》
《数据分析》实验结束后,整理数据如下:(注:集气瓶容积为100mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入瓶中水的体积(mL) | 20 | 18 | 19 | 17 | 21 | 19 |
通过对实验数据分析,实验得出氧气约占空气体积的__________。
《实验分析》(1)红磷要过量的原因是____________________;
(2)弹簧夹打开的适宜时机是__________________;
(3)实验结束,发现测定出的空气中氧气的体积分数低于l/5,可能的原因是_____(答出一点即可)
《改进实验》
(1)第二小组同学设计了C实验装置,优点是:_________________。
(2)第三小组同学设计了D实验装置,优点是:_________________。