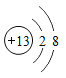题目内容
【题目】化学小组根据氨气还原氧化铜的反应,设计实验测定Cu元素的相对原子质量。
已知:①2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
②氨气(NH3)是碱性气体,能与硫酸反应,请结合如图回答问题:
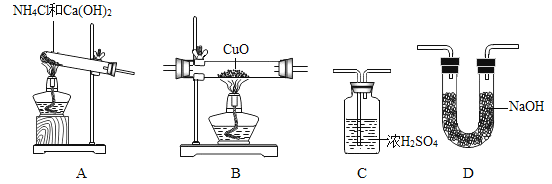
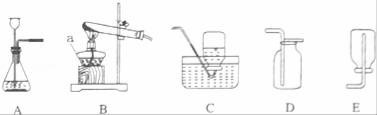
(1)写出指定仪器的名称:①_____;
(2)将纯净干燥的氨气通入B中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体,写出B中发生反应的化学方程式为:_____。测定Cu元素相对原子质量的实验过程为:先称量CuO的质量,完全反应后测定生成水的质量,由此计算出Cu元素的相对原子质量。小组同学利用如图进行实验,下列装置连接合理的是(填序号,装置可重复使用)_____。
①ACBDC
②ADBCD
③ADBDC
④ABDC
【答案】酒精灯 3CuO+2NH3![]() 3Cu+3H2O+N2 ②
3Cu+3H2O+N2 ②
【解析】
加热条件下氨气和氧化铜反应生成铜、水和氮气。
(1)①仪器的名称:①是酒精灯。
(2加热条件下氨气和氧化铜反应生成铜、水和氮气,故B中发生反应的化学方程式为3CuO+2NH3![]() 3Cu+3H2O+N2。装置连接合理的是A(制取氨气)D(干燥氨气)B(氨气和氧化铜反应)C(吸收反应生成的水蒸气)D(防止空气中的水蒸气进入C装置),故选②。
3Cu+3H2O+N2。装置连接合理的是A(制取氨气)D(干燥氨气)B(氨气和氧化铜反应)C(吸收反应生成的水蒸气)D(防止空气中的水蒸气进入C装置),故选②。

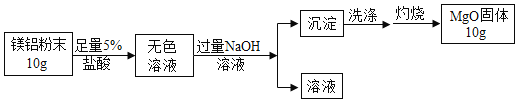
【题目】在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.

(1)贝壳高温煅烧时,发生反应的化学方程式是:______________________________;
(2)操作Ⅰ的名称是___________________;
(3)该流程中没有涉及的基本反应类型是___________________;
(4)固体B的化学式为_________________;
(问题与发现)
该小组同学所得到固体C一定是纯净的![]() 吗?
吗?
(猜想与假设)
根据反应原理,甲.乙.丙三位同学提出以下猜想:
甲:纯净的![]() ;
;
乙: ![]() 和
和![]() 的混合物;
的混合物;
丙: ![]() 和
和![]() 的混合物
的混合物
(探究与验证)甲.乙.丙三位同学分别设计下列方案,对自己的猜想进行验证实验操作.现象和结论如下表,请参与他们的探究并完成所缺内容
实验操作 | 现象 | 结论 | |
甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液; | 溶液变红 | 猜想成立 |
乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量_________; | 无气泡产生 | 猜想不成立 |
丙溶液 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和的M | __________ | 猜想成立 |
(1)丙同学实验中滴加的M溶液可能是______________,写出该反应的化学方程式_________________
(2)乙、丙同学认为甲同学的实验方案不正确,其理由是____________________________
【题目】核外电子的排布
(1)核外电子排布特点:_________排布。
电子层:表示核外电子运动的区域。
电子层数:一 二 三 四 五 六 七
能量:→由________到_________。
离核距离:→由________到_________。
(2)最外层:离核最________、能量最_______的电子层。
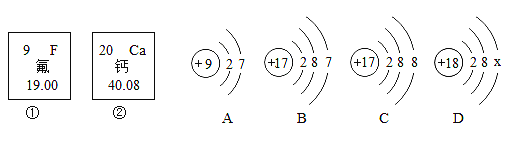
(3)原子结构示意图

①_______;②_________;③_______;④_______;⑤_______。
(4)元素的性质和原子结构的关系
①稳定结构:最外层电子数达到_________个(第一层为最外层电子数达到_________个)的结构。
②
最外层电子数特点 | 结构的稳定性 | 化学性质 | |
金属元素 | _______ | _______ | _______ |
非金属元素 | _______ | _______ | _______ |
稀有气体元素 | _______ | _______ | _______ |
最外层电子数决定元素__________。