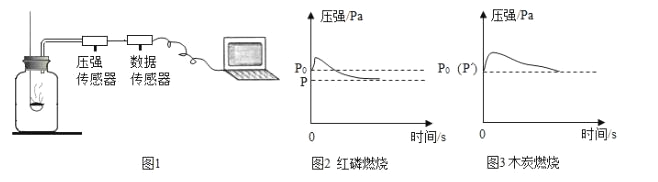
题目内容
【题目】甲、乙两种固体物质在水中的溶解度曲线如图所示。下列说法正确的是( )
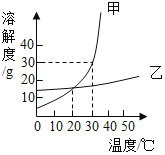
A. 10℃时,甲溶液的溶质质量分数小于乙溶液
B. 20℃时,将乙的饱和溶液升温至30℃,其溶质的质量分数变大
C. 30℃时,向20g甲固体中加入50g水,充分搅拌后得到70g溶液
D. 甲中含有少量乙时,可以用冷却热饱和溶液的方法提纯甲
【答案】D
【解析】
A、溶质质量分数=![]() 选项中没有说明溶质和溶液的质量,故无法比较,应该是10℃时,饱和的甲溶液的溶质质量分数小于饱和的乙溶液,故错误;
选项中没有说明溶质和溶液的质量,故无法比较,应该是10℃时,饱和的甲溶液的溶质质量分数小于饱和的乙溶液,故错误;
B、乙的溶解度随温度的升高而升高,将乙的饱和溶液升温,溶液中溶质和溶剂的质量不变,其溶质的质量分数不变,故错误;
C、由图知,30℃时甲的溶解度为30g,即100g水中溶解30g甲刚好达到饱和状态,所以50g水中最多只能溶解15g甲,向20g甲固体中加入50g水,充分搅拌后得到65g溶液,故错误;
D、甲的溶解度受温度的影响变化比较大,而乙的溶解度受温度的影响比较小,甲中含有少量乙时,可以用冷却热饱和溶液的方法提纯甲,故正确。
故选D。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
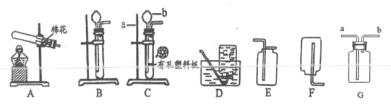
金博士一点全通系列答案【题目】被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的双氧水(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体。在化学实验开放日,实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
实验步骤 | 实验现象 | 实验结论 |
①将等体积的两种无色液体分别加入A、B两个试管中。
②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象。 | A试管中无明显现象 B试管中______ | A试管中的无色液体是:______; B试管中的无色液体是:双氧水 |
(1)B试管中发生反应的文字或符号表达式:______。
(2)如何验证B试管中产生的气体,请试着完成下表:
猜想 | 验证方法及操作 | 实验现象 | 结论 |
______ | ______ | ______ |
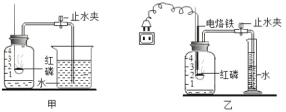
【题目】某化学兴趣小组为探究化学反应中的能量变化,进行以下实验:
(探究一)盐酸与氢氧化钠的反应
(1)写出氢氧化钠溶液与盐酸反应的化学方程式:_________________________________。
(2)甲同学设计实验:向一定量氢氧化钠固体中倒入20mL 4%盐酸,用温度计测量反应前后各溶液的温度。乙同学认为该实验方案不合理,其理由是_________________________。
(3)丙同学设计了如下三组实验,请你帮助他完成实验方案:
实验编号 | 实验方案 |
实验1 | 向20mL 4%盐酸中倒入20mL水,测定稀释前后溶液的温度。 |
实验2 | 向20mL 5%氢氧化钠溶液中________________,测定稀释前后溶液的温度。 |
实验3 | _______________________________________________________________。 |
(4)丙同学观察到的实验现象是:实验3溶液升高的温度远大于实验1与实验2溶液升高的温度之和,由此你能得出的实验结论是①____________;②____________。
(探究二)盐酸与碳酸氢钠溶液的反应。
下图是丁同学在20℃、基本隔热条件下利用温度传感器,分别测定向20mL水和20mL饱和碳酸氢钠溶液中各倒入20mL 13.7%盐酸的温度与时间变化曲线。
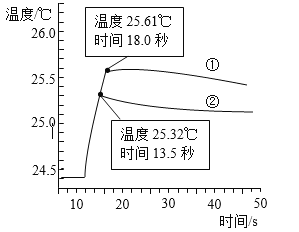
曲线①为水+13.7%盐酸温度变化曲线
曲线②为饱和碳酸氢钠溶液+13.7%盐酸温度变化曲线
实验测得饱和碳酸氢钠溶液稀释时温度变化不大,可忽略不计,据此回答下列问题:
(5)18.0秒后,曲线①逐渐下降的原因是____________________________________;
(6)比较曲线①和曲线②,你认为13.7%盐酸与饱和碳酸氢钠溶液的反应是________(填“放热”或“吸热”)反应,其理由是_________________________。