题目内容
【题目】实验室利用下列装置可以制取某些气体,请据图回答问题:
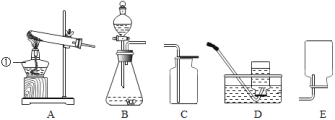
(1)这五个装置示意图中,有一个装置是错误的,其中错误装置是________ (填序号).
(2)图示中仪器①的作用________;实验室用高锰酸钾来制取氧气,可以选择A作发生装置,但要对A装置进行改进,改进的方法是________;实验室若用B装置制取氧气,则该反应的文字表达式为________.
(3)装药品之前,如何检查A装置的气密性?
(4)乙炔又称电石气,是一种无色、无味、密度比空气略小、不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石(固体)与水反应制取乙炔.你认为制取乙炔应选择的发生装置是________;收集装置是________.
(5)装置A、B都可以用来制取氧气,比较这两个装置的不同,则B装置的优点是________.
(6)已知氧气的密度为1.429g/L,氮气的密度为1.251g/L,试计算空气中氧气与氮气的质量比________.
【答案】E加热在试管塞一团棉花过氧化氢![]() 水+氧气把试管和带导管的橡皮塞连接,将导管一端伸入水中,用手捂住试管,若导管口有气泡冒出,且松手后导管内形成一段水柱,则气密性良好BD不用加热5:16
水+氧气把试管和带导管的橡皮塞连接,将导管一端伸入水中,用手捂住试管,若导管口有气泡冒出,且松手后导管内形成一段水柱,则气密性良好BD不用加热5:16
【解析】
(1)E装置中,导管伸入集气瓶太短,不利于排尽里面的空气,会使收集的气体不纯,因此E装置是错误的;
(2)①的名称是酒精灯,常用作热源;实验室用高锰酸钾来制取氧气需要加热,应该用A装置作为发生装置;为了防止高锰酸钾进入导管,需要在试管口塞一团棉花;过氧化氢在二氧化锰的催化作用下分解生成水和氧气,文字表达式为:过氧化氢![]() 水+氧气;
水+氧气;
(3)装药品之前,检查A装置的气密性的方法是:把试管和带导管的橡皮塞连接,将导管一端伸入水中,用手捂住试管,若导管口有气泡冒出,且松手后导管内形成一段水柱,则气密性良好;
(4)实验室制取乙炔的反应物是固体和液体,反应条件是常温,乙炔密度比空气略小、不溶于水的气体,所以制取乙炔应选择的发生装置是B,收集装置是D;
(5)高锰酸钾制取氧气的反应条件是加热,过氧化氢制取氧气的反应条件是常温,所以装置A、B都可以用来制取氧气,比较这两个装置的不同,则B装置的优点是不用加热;
(6)氧气的密度为1.429g/L,氮气的密度为1.251g/L,所以空气中氧气与氮气的质量比是:(1.429g/L×21%V):(1.251g/L×78%V)=5:16。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
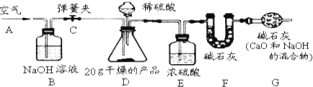
欣语文化快乐暑假沈阳出版社系列答案【题目】某校化学兴趣小组就空气中氧气的含量进行了如下实验探究:
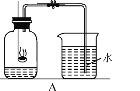
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其他成分反应,而且生成物为固体。他们应该选择________ (填序号),为了充分消耗容器中的氧气,药品的用量应保证足量 。
A.蜡烛 B.红磷 C.硫 D.木炭
(2)小组同学共同设计如图所示的装置,为了确保实验的成功,在装药品之前应该____,写出集气瓶内反应的文字表达式:____
(分组实验)在讨论的基础上,他们分组进行了实验。
(数据分析)实验结束后,整理数据如下表:(注:集气瓶容积为 100 mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积/mL | 20 | 21 | 19 | 20 | 22 | 18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的____。通过实
验还可以推断出集气瓶中剩余气体的性质是____、____(写出两点)。
(4)实验测量值比真实值小的原因可能是:①____量不足;②装置气密性____;③未冷却至____就打开止水夹。
【题目】某同学在学完《分子和原子》后,对.教材中所示的实验进行了如图所示的改进:

![]() 在小试管中加入
在小试管中加入![]() 片氢氧化钠固体的作用是________.
片氢氧化钠固体的作用是________.
![]() 滴入
滴入![]() 滴浓氨水后,在
滴浓氨水后,在![]() 处可观察到的现象是________.
处可观察到的现象是________.
![]() 改进后的装置除操作简单、现象明显、药品用量少、省时等优点外,还有一个显著的优点是________.
改进后的装置除操作简单、现象明显、药品用量少、省时等优点外,还有一个显著的优点是________.
某同学在实验结束进行废液处理时,将氢氧化钠溶液、石灰水和盐酸倒入同一洁净的烧杯中,当他用手接触烧杯壁时,感觉到烧杯“发热”.这一现象引起了他的注意.为了解这三种物质之间的反应情况,他决定从反应后溶液中溶质的组成入手进行探究.
![]() 他对反应后溶液中溶质的组成作出了两种合理的假设.
他对反应后溶液中溶质的组成作出了两种合理的假设.
假设①:溶质为![]() 、
、![]()
假设②:溶质为![]() 、
、![]() 、
、![]() 、
、![]()
请你再补充一种合理的假设.
假设③:溶质为________.
![]() 如果假设③成立,请你根据下表要求,设计一个实验方案进行验证.
如果假设③成立,请你根据下表要求,设计一个实验方案进行验证.
实验步骤及操作方法 | 实验现象 | 结论 |
______________ | ______________ | 假设③成立 |
![]() 比较三种假设,能说明该同学作出假设的理由是________.
比较三种假设,能说明该同学作出假设的理由是________.