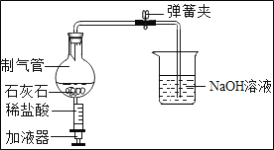
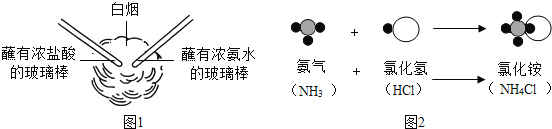
题目内容
【题目】如图是两种原子的结构示意图和它在元素周期表中的部分信息,完成下列问题.
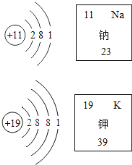
![]() 钠原子和钾原子质量之比为________.
钠原子和钾原子质量之比为________.
![]() 钠原子比钾原子的半径________.(填“大”或“小”)
钠原子比钾原子的半径________.(填“大”或“小”)
![]() 两种原子具有相似化学性质的原因是________.写出氧化钠与水反应的化学方程式________.
两种原子具有相似化学性质的原因是________.写出氧化钠与水反应的化学方程式________.
![]() 在多电子的原子中,核外电子分层排布的原因是________.
在多电子的原子中,核外电子分层排布的原因是________.
【答案】23:39小最外层电子数相同Na2O+H2O=2NaOH电子在原子中处于不同的能级状态,按能量不同分层排布,即电子在核外是分层排布
【解析】
(1)钠原子和钾原子质量之比为23:39;
(2)同主族元素从上到下,元素的原子半径逐渐增大;钠原子比钾原子的半径小;
(3)两种原子具有相似化学性质的原因是最外层电子数相同;氧化钠与水反应生成氢氧化钠,反应的化学方程式为:Na2O+H2O=2NaOH;
(4)电子在原子中处于不同的能级状态,按能量不同分层排布,即电子在核外是分层排布。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
【题目】为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气质量的实验数据如表所示,试求:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(mL) | 10 | 10 | 10 |
生成氢气的质量(g) | 0.08 | m | 0.04 |
(1)m=________
(2)此黄铜样品中锌的质量分数是多少______?