题目内容
【题目】常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得。
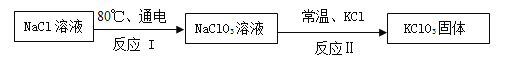
(1)反应I中,通电时发生的反应方程式为NaCl+3X=NaClO3+3H2↑,则X的化学式为_____。
(2)反应Ⅱ的基本反应类型为_____。
(3)该转化中可以循环利用的物质是_____(填名称)。
【答案】H2O 复分解反应 氯化钠
【解析】
(1)反应I中,通电时发生的反应方程式为NaCl+3X═NaClO3+3H2↑,反应后有钠原子1个,氯原子1个,氢原子6个,氧原子3个,反应前有钠原子1个,氯原子1个,少6个氢原子和3个氧原子,分布在三个X分子中,所以X的化学式为 H2O;
(2)反应Ⅱ是氯酸钠和氯化钾反应生成氯酸钾和氯化钠,是两种化合物相互交换成分生成两种新的化合物,属于复分解反应;
(3)该转化中,开始使用了氯化钠,反应后生成了氯化钠,所以可以循环利用的物质是氯化钠。

 阅读快车系列答案
阅读快车系列答案【题目】3.0g某物质完全燃烧后生成4.4gCO2和1.8g水.则对该物质相关判断正确的是( )
| A. | 该物质只含碳、氢元素 |
| B. | 该物质一定含有碳、氢元素,可能含有氧元素 |
| C. | 该物质由碳、氢、氧元素组成 |
| D. | 该物质分子中碳原子和氢原子的个数比为1:1 |
【题目】在一次趣味化学活动中,老师向同学们展示了一瓶标签受损的无色溶液,如图所示,要求同学们进行探究:确认这瓶无色溶液是什么?

(提出猜想)老师提示:这瓶无色溶液只可能是下列三种溶液中的一种:①氯化钠溶液②硫酸钠溶液③碳酸钠溶液
(实验探究)(1)陈丹同学仔细观察了试剂瓶的标签,认为猜想_____(填序号)不成立,其原因是_____。
(2)为确定其它几种猜想是否正确.陈丹同学继续进行探究:
实验操作 | 实验现象 | 实验结论 |
取该溶液少许于试管中,向其中滴加稀盐酸 | 无明显现象 | _____ |
_____ | 猜想③成立 |
(反思与交流)(3)小雨同学经查阅资料获知,氯化钠溶液、硫酸钠溶液的pH都等于7。于是他提出还可以用测pH的方法来确定该无色溶液。请你简述用pH试纸测定溶液pH的方法:_____。
小雨同学用pH试纸怎样确定这瓶无色溶液是碳酸钠溶液?_____。