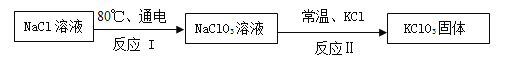
题目内容
【题目】下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。

(1)20℃时,甲的溶解度_____(填“>”、“<”或“=”)乙的溶解度。
(2)40℃时,乙和丙_____(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
(3)20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。请在下表写出烧杯中固体的变化。
烧杯中的溶质 | 烧杯中固体的变化 |
甲 | _____ |
乙 | 固体逐渐减少至全部溶解 |
丙 | _____ |
【答案】< 能 固体逐渐减少,至全部溶解 固体逐渐增加
【解析】
Ⅰ、20℃时,甲的溶解度小于乙的溶解度;
Ⅱ、40℃时,乙和丙的溶解度相等,据饱和时质量分数的计算式![]() ×100%可知:溶解度相等则溶质的质量分数相等,故可以形成乙和丙溶质质量分数相等的饱和溶液;
×100%可知:溶解度相等则溶质的质量分数相等,故可以形成乙和丙溶质质量分数相等的饱和溶液;
Ⅲ、甲和乙的溶解度随温度的升高而逐渐增大,且20℃至50℃时甲的溶解度变化比乙大,而乙固体能全部溶解,所以升高温度烧杯中的甲固体也将逐渐减少,至全部溶解;丙的溶解度随温度的升高而逐渐减小,所以升高温度,丙烧杯中固体的质量将逐渐增加;
故答案为:
Ⅰ、<;
Ⅱ、能;
Ⅲ、
烧杯中的溶质 | 烧杯中固体的变化 |
甲 | 固体逐渐减少,至全部溶解 |
乙 | 固体逐渐减少至全部溶解 |
丙 | 固体逐渐增加 |

【题目】硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量/g | 硫酸铜溶液的质量/g | 烧杯和烧杯中溶液的质量/g |
60 | 3.3 | 62.5 | |
(1)生成氧气的质量为________.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).
【题目】“双吸剂”是常用的食品保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体。某化学小组的同学在袋装食品中发现一包久置的双吸剂,其标签如下图所示。

(提出问题)久置固体的成分是什么?
(收集资料)
(1)查阅资料:铁与氯化铁溶液在常温下生成氯化亚铁:Fe+2FeCl3=3FeCl2。
(2)打开固体包装观察:部分粉末呈黑色、部分粉末呈白色、另有少量红棕色的块状固体。
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。猜想固体中可能含有Fe2O3的依据是_____。
(实验探究)下表是甲组同学设计并记录的实验报告,请你补充完整。
实验操作 | 实验现象 | 实验结论 |
一、取少量固体加入足量蒸馏水,搅拌溶解 | 固体部分溶解,并放出大量热 | 固体中一定含有_____ |
二、过滤,取滤液滴加无色酚酞溶液 | 溶液变红色 | 固体中一定含有氢氧化钙 |
三、取滤渣加入足量稀盐酸 | 固体逐渐消失,产生大量无色气体,得到浅绿色溶液 | 固体中一定含有_____,一定不含有Fe2O3 |
四、将操作三中产生的气体通入到澄清石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有_____ |
(实验质疑)乙组同学认为甲组同学第二步操作得出的结论不合理,理由是_____(用化学方程式表示)。甲组同学第三步操作得出“一定不含有Fe2O3”的结论也是错误的,理由是_____。
(继续探究)为验证固体中是否含有Fe2O3,乙组同学用磁铁先分离出铁粉,向残留固体中加入足量稀盐酸,若溶液呈_____色,证明固体中含有Fe2O3,写出该反应的化学方程式_____。