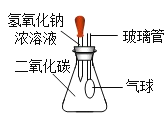
��Ŀ����
����Ŀ��������ͬѧ�Dzⶨ��ͭ��ͭп�Ͻ���ͭ�����������Ĺ��̡�
(1)С��ͬѧȡ10g��ͭ������������ϡ���ᣬ���ռ�������0.2g�����ͭ��ͭ�����������Ƕ��٣�____________________��д��������̣�
(2)С��ͬѧ��ȡ10g��ͭ���ձ��У����ձ��м���ϡ���ᣬ��ü����ϡ�����������ձ���ʣ������������±���
����ϡ���������/g | 30 | 60 | 90 | 120 |
�ձ���ʣ���������/g | 39.94 | m | 99.82 | 129.8 |
�ٱ���m=____________���ӱ��е����ݷ�������С��ͬѧ����_________gϡ����ʱ���ձ��иպ�û�����ݲ�����
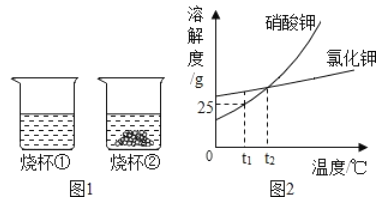
��������ͼ����10g��ͭ����ϡ����������������������ͼ��____________________��
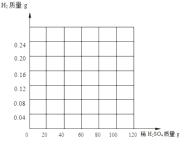
���𰸡�35%������������̣� 69.88 100 
��������
��1������뷴Ӧ��п������Ϊx��
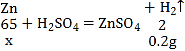
![]() ��ã�x=6.5g��
��ã�x=6.5g��
����Ʒ��ͭ����������=![]()
�𣺸���Ʒ��ͭ����������Ϊ35%��
��2�����ɱ������ݷ���ÿ����30gϡ���ᣬ��������������Ϊ10g+30g-39.94g=0.06g��������90gϡ����ʱ���������������Ϊ10g+90g-99.82g=0.18g��˵��90gϡ������ȫ���ģ���������60gϡ���ᣬ��������������Ϊ10+60-m=0.12��m=69.88��������120gϡ����ʱ���������������Ϊ10g+120g-129.8g=0.2g����������ϡ��������Ϊ![]() ��
��
�ڸ���ǡ�÷�Ӧʱ����������0.2g������ϡ����100g����Ӧ��ǰ�����������������ӣ��ɵã�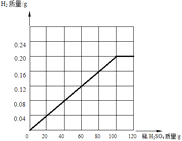 ��
��

����Ŀ��ijƷ�ƿ�Ȫˮ�ı�ǩ�ϱ����Ŀ�Ȫˮ��Ҫ�ɷ������ʾ������ݱ����ش��������⡣
ˮ����Ҫ�ɷ֣�mg/L�� | |
ƫ���ᣨH2SiO3��������28.9����42.9 ̼���������HCO3��������173����205 þ��Mg2+��������2.5����7.5 | �ȣ�Sr������0.01����0.32 �ơ�����5����45 PH������7.8��0.5 |
��1�������ӵĻ�ѧ������_____��
��2��ƫ���ᣨH2SiO3���й�Ԫ�صĻ��ϼ�Ϊ_____��
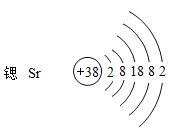
��3��������ԭ�ӽṹʾ��ͼ��д���Ȼ��ȵĻ�ѧʽ_____��