题目内容
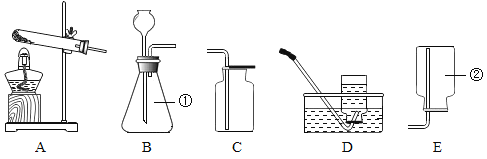
【题目】化学是一门以实验为基础的学科,请结合下列图示实验装置,回答问题.
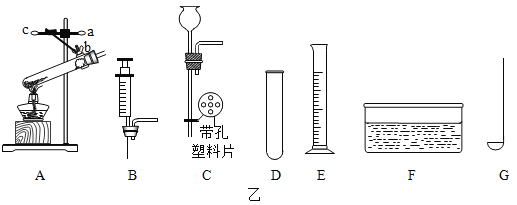
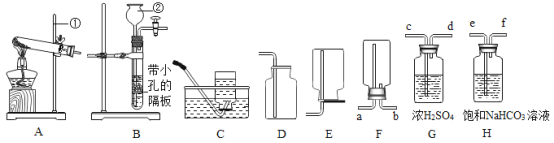
(1)图中①、②仪器的名称是:①_____ ②_____。
(2)用高锰酸钾固体制取较纯的氧气时,可选用的发生装置和收集装置是_____(填字母序号),反应的化学方程式是_____。
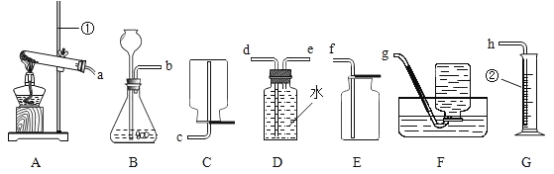
(3)小阳欲制取并测定生成氢气的体积,请从上图A~G中选择最佳的装置进行组合,整套装置的导管口连接顺序是b→_____(填接口序号)。
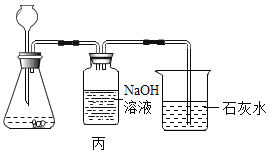
(4)小李用锥形瓶收集一瓶二氧化碳气体,并利用如图所示的装置做趣味实验,他将胶头滴管中氢氧化钠溶液挤压到锥形瓶后,可以观察到的现象为_____,其原因是_____。
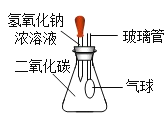
【答案】铁架台 量筒 AF(或AD) 2KMnO4![]() K2MnO4+MnO2+O2↑ d→e→h 气球膨胀 氢氧化钠溶液与瓶内二氧化碳反应,导致瓶内压强减小
K2MnO4+MnO2+O2↑ d→e→h 气球膨胀 氢氧化钠溶液与瓶内二氧化碳反应,导致瓶内压强减小
【解析】
(1)根据常用仪器可知图中①、②仪器分别是铁架台、量筒;
(2)用高锰酸钾固体制取较为纯净的氧气时,由于是固体受热产生气体,所以应该选用加热制取氧气的装置,故选A装置;而较为纯净的气体不能用排空气法收集,只能用排水法收集,故选F或D装置收集。用高锰酸钾固体制取较纯的氧气时,可选用的发生装置和收集装置是AF(或AD);高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式是2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)测定生成氢气的体积,可利用排水法收集氢气,故选F装置;氢气的密度比水小,故从e进d出;通过测定排出水的体积确定生成氢气的体积,所以还需选择G装置;故答案为:e→d→h;
(4)氢氧化钠能与二氧化碳反应生成碳酸钠和水,使瓶内的气体被消耗,压强变小,气球变大。

 阅读快车系列答案
阅读快车系列答案【题目】下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程。
(1)小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?____________________(写出计算过程)
(2)小婷同学另取10g黄铜于烧杯中,向烧杯中加入稀硫酸,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
加入稀硫酸的质量/g | 30 | 60 | 90 | 120 |
烧杯中剩余物的质量/g | 39.94 | m | 99.82 | 129.8 |
①表中m=____________,从表中的数据分析,当小婷同学加入_________g稀硫酸时,烧杯中刚好没有气泡产生。
②请在下图画出10g黄铜加入稀硫酸与生成氢气的质量的图像____________________。