题目内容
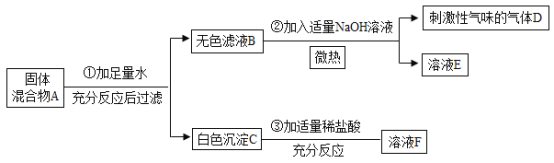
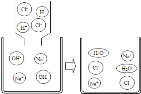
【题目】实验室有一包粉末状物质,可能由 NaCl、Na2SO4、Ma2CO3、FeCl3中的一种或几种组成。为了确定原粉末的成分,某校化学兴趣小组的同学,按图所示进行实验。按要求回答下列问题:

(1)操作Ⅰ的名称是____________。
(2)为了不干扰对第③步实验现象的判断,试剂B最好选择____________。请写出步骤③的化学反应方程式_______________。
(3)通过实验可以确定该粉末中一定不含______________。
【答案】过滤 稀盐酸(或HCl) Na2SO4+BaCl2=2NaCl+BaSO4↓ FeCl3
【解析】
氯化铁在溶液中显黄色,碳酸盐和酸反应会生成二氧化碳气体,硫酸根离子和钡离子反应会生成硫酸钡沉淀,
样品中加入足量的A,得到无色溶液,所以样品中一定不含氯化铁,加入足量的B会生成无色气体,所以样品中一定含有碳酸钠,无色溶液中加入足量的氯化钡会得到白色沉淀,所以样品中一定含有硫酸钠,所以
(1)过滤可以将不溶性固体从溶液中分离出来,所以操作I的名称是过滤;
(2)为了不干扰对第③步实验现象的判断,试剂B最好选择稀盐酸,步骤③是氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl;
(3)通过实验可以确定该粉末中一定不含FeCl3。
故答案为:(1)过滤;
(2)稀盐酸,BaCl2+Na2SO4=BaSO4↓+2NaCl;
(3)FeCl3。

【题目】运用溶解度表与溶解度曲线回答下列问题:
温度/°C | 10 | 30 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
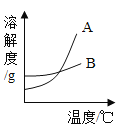
(1)B是 _____________(填“氯化钠”或“硝酸钾”)的溶解度曲线。
(2)60℃时,向100g水中加入100g硝酸钾,所得溶液的溶质质量分数为_____________,当该溶液从60℃降温到30℃时,析出晶体的质量为_____________g。
(3)现有50℃A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是_____(填序号)。
①降低温度 ②升高温度 ③加入A物质