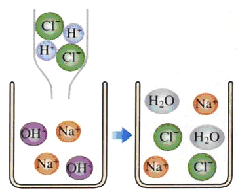
题目内容
【题目】运用溶解度表与溶解度曲线回答下列问题:
温度/°C | 10 | 30 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
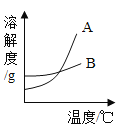
(1)B是 _____________(填“氯化钠”或“硝酸钾”)的溶解度曲线。
(2)60℃时,向100g水中加入100g硝酸钾,所得溶液的溶质质量分数为_____________,当该溶液从60℃降温到30℃时,析出晶体的质量为_____________g。
(3)现有50℃A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是_____(填序号)。
①降低温度 ②升高温度 ③加入A物质
【答案】氯化钠 50% 54.2 ②
【解析】
分析氯化钠和硝酸钾的溶解度表和曲线,解答相关问题。
(1)根据溶解度表,在10℃时氯化钠的溶解度大于硝酸钾的溶解度,在30℃时氯化钠的溶解度小于硝酸钾的溶解度,所以B是氯化钠的溶解度曲线。
(2)在60℃时,硝酸钾的溶解度为110g,向100g水中加人100g硝酸钾, 100g硝酸钾完全溶解在100g水中,所得溶液的溶质质量分数为![]() 。在30℃时硝酸钾的溶解度为45.8g,也就说100g水中最多能溶解硝酸钾45.8g,当该溶液从60℃降温到30℃时,析出晶体的质量为
。在30℃时硝酸钾的溶解度为45.8g,也就说100g水中最多能溶解硝酸钾45.8g,当该溶液从60℃降温到30℃时,析出晶体的质量为![]() 。
。
(3)A物质的溶解度是随温度的升高而增大,现有50℃A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,可以采用降低温度或加入A物质,而升高温度A物质的溶解度增大,不可能变成饱和溶液。故选②。

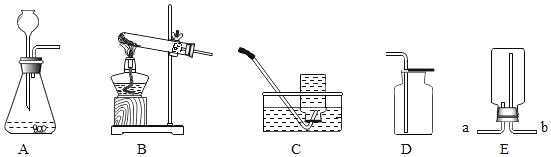
【题目】某化学小组的同学在老师的指导下,设计如下装置验证碳酸钙的性质的同时,探究氧化钙与二氧化碳在加热的条件下是否也能发生反应生成碳酸钙。

(1)C中的反应方程式为_____。
(2)实验后小组同学对E中固体的成分进行探究。
[猜想与假设]E中的固体可能为a氧化钙; b氧化钙与碳酸钙; C 碳酸钙
[进行实验]
实验步骤 | 现象 | 结论或化学方程式 |
①取一定量的E中固体于试管中,并加入一定量的水,振荡。 | 有白色不溶物 | 能否证明猜想c成立_____(填能、否),理由是_____。 |
②取一定量的E中固体于试管中,并加入一定量的水并滴加_____试液。 | 试管中液体显红色 | 试管中反应的化学方程式_____。 |
③再在上述试管中滴加足量的稀盐酸。 | 试液中有气泡产生 | 证明所取一定量E中固体的成分是_____(填化学式)。 |
(3)煅烧含碳酸钙50克的石灰石,完全分解则产生氧化钙的物质的量是多少? _____(根据化学方程式列式计算)