题目内容
【题目】现欲探究一固体混合物A的成分,已知其中可能含有CuSO4、Mg(OH)2、NH4NO3、NaCl、BaSO4 五种物质中的两种或多种。按图所示进行实验,出现的现象如下图中所述(设过程中所有可能发生的反应都恰好完全进行)。
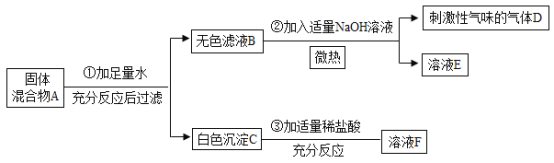
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)滤液E中大量存在的金属阳离子为(写离子符号)_____。
(2)混合物A中,肯定不存在的物质是(写化学式)_____。
(3)写出实验过程②中所发生反应的化学方程式_____。
【答案】Na+ CuSO4、BaSO4 ![]()
【解析】
硫酸铜在溶液中显蓝色,硫酸钡沉淀难溶于酸,铵根离子和氢氧根离子反应会生成氨气,所以由实验①加足量水充分反应后过滤,得到无色溶液和白色沉淀,说明A固体混合物中不含硫酸铜;
由实验②加入适量的NaOH溶液微热,放出刺激性气味的气体,可判断固体混合物A中含有硝酸铵,气体D为氨气;
由实验③加适量稀盐酸充分反应,白色沉淀全部溶解,可确定固体混合物A中不含硫酸钡,而剩余的几种物质不能发生反应,所以白色沉淀C为五种物质中的氢氧化镁;
综合以上分析,可判断固体混合物中一定含有硝酸铵、氢氧化镁,一定不含有硫酸铜、硫酸钡,可能含有氯化钠;
(1)滤液E是氢氧化钠和硝酸铵反应生成硝酸钠和氨气和水,滤液E中大量存在的金属阳离子为Na+;
(2)混合物A中,肯定不存在的物质是 CuSO4、BaSO4;
(3)实验过程②中所发生的反应是硝酸铵和氢氧化钠在加热的条件下生成硝酸钠、水和氨气,化学方程式为:![]() 。
。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目