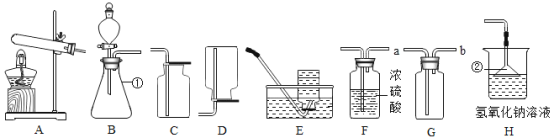
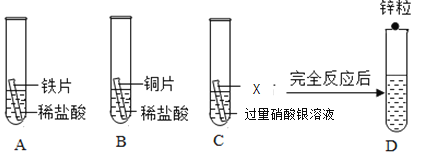
题目内容
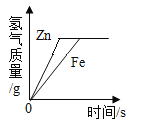
【题目】为了探究金属与酸反应的规律,某实验小组进行了如下实验:取等质量、同浓度的稀盐酸反应,用温度传感器得的反应过程中温度变化曲线如图所示。
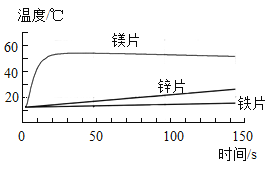
(1)请写出铁片与稀盐酸反应的化学方程式___________。
(2)请分析反应过程中温度升高的原因___________。
(3)根据曲线总结出金属活动性的相关规律___________。
【答案】![]() 金属与酸反应放出热量,使温度升高。 在相同条件下,金属活动性越强,与酸反应放出执量越多。
金属与酸反应放出热量,使温度升高。 在相同条件下,金属活动性越强,与酸反应放出执量越多。
【解析】
本题探究金属与酸反应溶液温度的变化。
(1)铁片与稀盐酸反应的化学方程式为![]() 。
。
(2)反应过程中温度升高的原因是金属与酸反应放出热量,使溶液的温度升高。
(3)根据三种金属的曲线分析,镁的活动性最强,放热量最多,锌的活动性比铁强,锌的放热量比铁的大,所以金属活动性越强,与酸反应放出热量越多。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】小刚同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究。
[猜想]猜想1:可以减少汽车尾气对空气的污染
猜想2:可以产生更多热量,增强汽车的动力。
[进行实验]
序号 | 实验步骤 | 实验现象 | 得出的结论 |
1 | 在两个蒸发皿中各加入10mL冷水,控制相同的燃烧条件,分别用乙醇和汽油作为燃料进行加热,记录从开始加热到水沸腾的时间。 | 用乙醇加热耗时118s,用汽油加热耗时56s | 猜想2______________ (填“成立”或“不成立”) |
2 | 实验1停止加热后,取下蒸发皿,观察蒸发皿的底部。 | 用乙醇加热的蒸发皿底部只有极少量的炭黑, 而用汽油加热的蒸发皿底部有大量的炭黑 | ____________(仿照 上格填写) |
[分析与讨论]
(1)实验1是一个对比实验,实验过程中不一定控制的条件是_______ (填序号)
A水的初始温度必须相同
B加热开始计时点必须相同
C燃具产生火焰的大小必须相同
D蒸发皿的大小必须相同
(2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将__________。
(3)目前乙醇汽油中乙醇的添加量约为10%,可在一定程度 上节省石油资源。结合实验1的结论分析,如果乙醇的添加量过大,会使汽车动力___________(填“增强”“减弱”或“不变”)
(4)乙醇燃烧的化学方程式为__________。
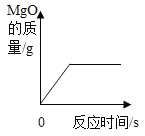
【题目】一定条件下,在一个密闭容器内有五种物质,充分反应后,测得反应前后各物质的质量如下:则下列推理不正确的是
物质 | A | O2 | CO2 | H2O | N2 |
反应前质量/g | 24.4 | 109.6 | 2.4 | 1.2 | 5.6 |
反应后质量/g | 0 | 100 | 20 | 12 | X |
A.物质A中碳元素和氢元素的质量比为4:1
B.物质A由碳、氢和氮三种元素组成
C.x=11.2
D.上述五种物质中有两种属于氧化物