题目内容
【题目】在密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是
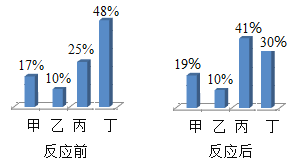
A.该反应是分解反应
B.生成的甲、丙两种物质的质量比为8:1
C.乙物质可能是该反应的催化剂
D.参加反应的丁物质的质量等于生成的甲物质和丙物质的质量之和
【答案】B
【解析】
由四种物质反应前后各物质的质量分数可知,反应前、后甲的质量分数增加了19%-17%=2%,故甲是生成物;乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应;反应后丙的质量分数增加了41%-25%=16%,故是生成物;丁的质量分数减少了48%-30%=18%,是反应物。
A、该反应的反应物是丁,生成物是甲和丙,是由一种物质生成两种物质的反应,符合分解反应的特征,属于分解反应,故A正确;
B、反应中甲、丙两物质的质量比例为2%:18%=1:9,故B错误;
C、乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应,故C正确;
D、参加反应的丁的质量等于生成的甲和丙的质量之和,故D正确。故选B。

【题目】实验技能训练中,小亮同学向氧化铜和稀硫酸充分反应后的废液中加入一定量的氢氧化钠溶液,发现无明显现象。小亮同学在老师的指导下对反应后的废液进行了实验:他分别取50g废液,并向其中逐渐加入等浓度的氢氧化钠溶液,三组实验的数据与其中一组的图象如下:
实验组数 | 第一组 | 第二组 | 第三组 |
加入氢氧化钠溶液质量/g | 50 | 100 | 80 |
产生沉淀的质量/g | 0.98 | 2.94 | 2.94 |
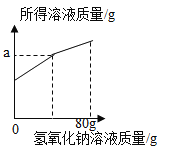
请根据以上信息回答下列问题:所得
(1)废液中的溶质有_____(填化学式)。
(2)计算废液中硫酸铜的溶质质量分数。_____(写出计算过程)
(3)若三组数据中,只有某一组加入的氢氧化钠溶液与废液恰好完全反应,则该实验为第_____组,下图中a的数值为_____。
【题目】探究物质燃烧。巴黎圣母院大火造成的重大损失再次提醒人们,合理的控制燃烧非常重要,小明利用下列装置对物质燃烧进行探究,探究过程和观察记录如下:
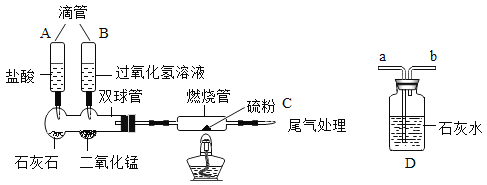
实验①:根据装置图组装仪器,不点燃酒精灯,观察到硫不燃烧。
实验②:点燃酒精灯,观察到硫燃烧,发出微弱的淡蓝色的火焰。
实验③:更换燃烧管(装有等量硫粉),挤压滴管A,在尾气处理接口接上D装置,观察到溶液变浑浊后,点燃酒精灯,硫粉不燃烧。
实验④:更换燃烧管(装有等量硫粉),拆除D装置,挤压滴管B点燃酒精灯,硫粉燃烧发出明亮的蓝紫色火焰
(1)上述实验中的对照实验(填实验编号)和获得的相应结论。
第1组对照实验:_________,结论:__________。
第2组对照实验:_________,结论:__________。
第3组对照实验:_________,结论:__________。
(2)实验③中需待D中溶液变浑浊后再点燃酒精灯,其原因是________________。
(3)写出上述实验中发生化学反应的方程式___________________(不包括处理尾气的反应)
(4)有一种吹不灭的蜡烛,点燃后任你怎么吹也吹不灭。
(查阅资料)该蜡烛芯上包裹一层打火石的粉末。打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃。当蜡烛燃烧时,金属并不燃烧;但当蜡触吹灭后,未冷却的金属发生燃烧,从而使蜡触复燃。蜡烛燃烧时金属不燃烧的原因是__________;试再举一例运用此原理灭火的生活事例_______________。
(实验探究)吹不灭的蜡烛芯内的金属可能是镁、铁或铜中的一种,为确定该金属的成分,请你自选试剂继续探究并完成下列有关问题:(注:不考虑打火石中稀土元素对探究金属性质的影响)
操作步骤 | 现象 | 结论 |
切开蜡烛,取出打火机,用砂纸打磨 | 打火石是银白色 | __________ |
取少量打磨后的打火石于试管中,__________ | ____________ | 该金属是镁 |
在上述探究触芯内金属成分的过程中,运用的科学方法有_______________。
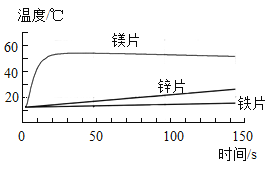
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中然烧的实验(如图1)。

(1)根据镁燃烧发出耀眼的白光这一特点,在军事上用于制造_____;
(2)同学们通过称量发现:即使不考虑参加反应的氧气的质量,在石棉网上收集到产物的质量也小于烧掉镁条的质量,看似该反应不遵循质量守恒定律。请你分析出现这种结果的原因可能是:_____;
(3)小红按图2装置进行实验,结果符合质量守恒定律,同时还发现产物中有少量黄色固体。决定探究黄色固体为何物。

(提出问题)黄色固体是什么?
(查阅资料)得到如下信息①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体:③氮化镁可与水剧烈反应产生氨气;④氨气有刺激性气味,能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体可能是Mg3N2;
(实验探究)请设计实验,验证猜想:
实验操作 | 实验现象 | 结论 |
_____ | _____ | 黄色固体是Mg3N2 |
(反思交流)
①写出镁条燃烧生成氮化镁的化学方程式为_____;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是_____。
③氢气也可以在氯气中能够燃烧,反应方程式为 。结合以上事实,请你谈一谈对燃烧的新认识_____。
。结合以上事实,请你谈一谈对燃烧的新认识_____。