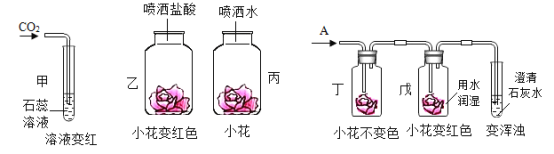
题目内容
【题目】小刚同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究。
[猜想]猜想1:可以减少汽车尾气对空气的污染
猜想2:可以产生更多热量,增强汽车的动力。
[进行实验]
序号 | 实验步骤 | 实验现象 | 得出的结论 |
1 | 在两个蒸发皿中各加入10mL冷水,控制相同的燃烧条件,分别用乙醇和汽油作为燃料进行加热,记录从开始加热到水沸腾的时间。 | 用乙醇加热耗时118s,用汽油加热耗时56s | 猜想2______________ (填“成立”或“不成立”) |
2 | 实验1停止加热后,取下蒸发皿,观察蒸发皿的底部。 | 用乙醇加热的蒸发皿底部只有极少量的炭黑, 而用汽油加热的蒸发皿底部有大量的炭黑 | ____________(仿照 上格填写) |
[分析与讨论]
(1)实验1是一个对比实验,实验过程中不一定控制的条件是_______ (填序号)
A水的初始温度必须相同
B加热开始计时点必须相同
C燃具产生火焰的大小必须相同
D蒸发皿的大小必须相同
(2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将__________。
(3)目前乙醇汽油中乙醇的添加量约为10%,可在一定程度 上节省石油资源。结合实验1的结论分析,如果乙醇的添加量过大,会使汽车动力___________(填“增强”“减弱”或“不变”)
(4)乙醇燃烧的化学方程式为__________。
【答案】不成立 猜想1成立 B 减少 减弱 
【解析】
设计与实验:
实验一中将等量的水加热至沸腾,乙醇用时间更长,说明乙醇燃烧放出的热量较少,说明添加酒精不是为了增强动力,即假设2不成立;
实验二发现酒精燃烧产生的环境污染物更少,证实添加酒精是为了减少尾气排放,即猜想1成立;
故答案为:不成立;猜想1成立;
分析与讨论:
(1)实验1是一个对比实验,初始温度、火焰的大小、蒸发皿的大小都需要控制相同;开始计时点不需要控制,只需比较哪个用时间长即可,故答案为:B;
(2)结合实验2可知,使用乙醇汽油后,这些部件产生的积炭量将减少,故答案为:减少;
(3)结合实验去可知,如果乙醇的添加量过大,乙醇燃烧放出的热量少,则会使汽车动力减弱,故答案为:减弱。
(4)乙醇燃烧生成二氧化碳和水,化学方程式为: 。
。

【题目】化学教材九年级上册第二单元“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了某化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象 | 试管中均产生气泡,带火星木条均复燃 |
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag | |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象 |
(实验结论)
(1)实验Ⅱ、Ⅲ证明:氧化铁的_____和_____在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(2)写出氧化铁催化过氧化氢分解的化学方程式_____。
(实验评价)
(1)设计实验Ⅳ的目的是_____。
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是_____。
(实验拓展)
查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以作过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是_____。
A MnO2只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质不可能是其他反应的反应物或生成物