题目内容
【题目】学校实验小组验证反应原理,在室温为15℃时,同学们将10g氢氧化钠固体完全溶解溶于80g水中,而后匀速的通入二氧化碳气体。同时用传感器测定溶液的pH变化,同时用数据采集器记录并绘制图像如图2所示。
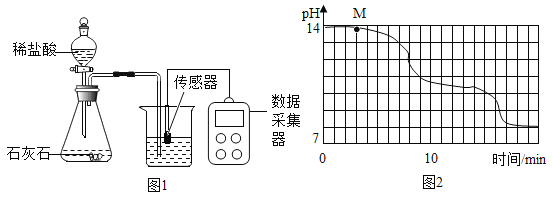
(1)图1所示实验中,用“分液漏斗”而不用“长颈漏斗”其原因是______________;
(2)通过图像分析,小苏打溶液是显________(填“酸性”、“中性”或“碱性”),图像中M点处发生的主要化学反应方程式为________________;
(3)为了确定M处溶液的成分,同学们进行如下实验:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
① | 滴入________ | 溶液变红 | 有________生成 |
② | 加入________ | _______ | _______ |
(4)实验过程中,同学们发现18min后溶液的pH基本不再变化,则此时烧杯中就可观察到的现象有________。
【答案】便于控制生成二氧化碳的速率 碱性 2NaOH+CO2═Na2CO3+H2O 滴入无色酚酞 氢氧化钠或碳酸钠 过量的 CaCl2溶液 有白色沉淀生成,且红色不消失 既有氢氧化钠,又有碳酸钠 有不溶物析出
【解析】
解:(1)分液漏斗便于控制液体的滴入量,从而控制生成二氧化碳的速率;
(2)通过图象分析,小苏打溶液的pH大于7,显碱性;图象中M点处发生的主要化学反应是二氧化碳与氢氧化钠反应,反应方程式为2NaOH+CO2═Na2CO3+H2O;
(3)为了确定M处溶液的成分,先滴入无色酚酞试液,溶液变红,则溶液显碱性,再加入过量的CaCl2溶液(显中性),有白色沉淀生成,且红色不消失,说明溶液中有碳酸钠和氢氧化钠;
(4)实验过程中,溶液中溶解过量的二氧化碳后,二氧化碳与溶液中的碳酸钠反应,生成碳酸氢钠,因为碳酸钠在水中溶解度大,碳酸氢钠在水中溶解度小,碳酸氢钠达到一定量时会析出。