题目内容
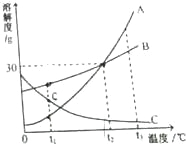
【题目】如图图像能正确反映其对应关系的是( )
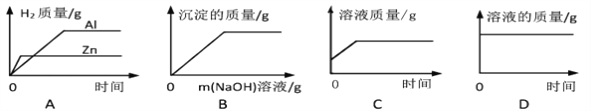
A. 等质量的锌片、铝片分别与足量且质量分数相同的稀硫酸反应
B. 向H2S04和CuS04的混合溶液中滴加NaOH溶液
C. 一定量的稀硫酸与锌片反应
D. 向不饱和的硫酸铜溶液中加入硫酸铜粉末
【答案】C
【解析】A、铝的金属活动性比锌强,反应时铝反应的速度比锌快,该图像反映锌的反应速度比铝快;依据反应的方程式 2Al+3H2SO4=Al2(SO4)3+3H2↑、Zn+H2SO4=ZnSO4+H2↑可以看出等质量的两种金属,铝生成的氢气较多,错误;B、向H2SO4和CuSO4的混合溶液中滴加NaOH溶液时,先要完成与稀硫酸的反应,开始不会生成沉淀,当硫酸消耗完后氢氧化钠才能与硫酸铜反应生成氢氧化铜的沉淀,错误;C、锌与稀硫酸反应时每一个锌原子会置换出一个氢气分子(56置换2),反应会导致溶液质量增加,直至反应结束,由于开始的溶液是稀硫酸的溶液,开始质量不是零,正确;D、向不饱和的硫酸铜溶液中加入硫酸铜粉末,硫酸铜溶解,溶液质量增加,错误;故选C。

【题目】阅读下面短文,回答相关问题。
生活中你是否遇到过这样的事情:你将苹果去皮、切块儿,等待妈妈下班回来。可是一段时间后,苹果块儿表面会生成一种褐色的物质,口感也不那么脆了......变化其实来自于苹果中存在的一种原本无色的多酚类的物质。这类物质能跟氧气结合,产生一些有色物质,这就是褐变过程。
防止苹果发生褐变过程的方法有很多。
碳酸氢钠是一种安全、价格低廉的化学物质,能够直接抑制水果病原真菌的生长,常用于水果贮藏保鲜。选择新鲜、大小均匀、无虫害无伤的苹果果实,消毒、清洗后切成12片,每片厚度约为15mm。切片立即浸泡于下表中的碳酸氢钠溶液中进行保鲜处理。每种浓度的碳酸氢钠溶液中浸泡2块苹果切片。5分钟后将苹果切片捞出、甩干,将12片苹果装在一个塑料保鲜盒中,置于4℃贮藏观察。
1 | 2 | 3 | 4 | 5 | 6 | |
碳酸氢钠溶液的溶度g/L | 0 | 0.5 | 2.0 | 5.0 | 10.0 | 15.0 |
pH | 7.01 | 8.00 | 8.12 | 8.20 | 8.25 | 8.33 |
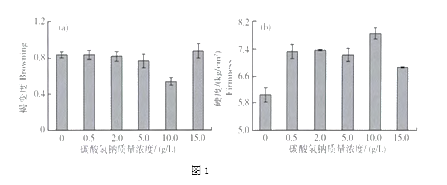
在贮藏3天后,取样测定其褐变度和硬度变化,记录的数据如下图1。
(注:褐变度表示苹果褐变的程度,数值越大褐变程度越高;硬度表示苹果的酥脆程度,数值越大说明越酥脆)
抗坏血酸(即维生素C)是一种抗氧化剂,也可以有效抑制苹果切分后褐变和变软。抗坏血酸在酸性环境下稳定,但是很难发挥抗氧化作用,在弱碱性环境下可以发挥很强的抗氧化作用。而苹果果实的pH一般在3.0~3.8。
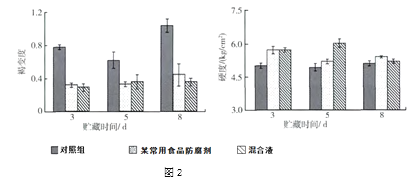
取三组苹果切片,分别用10g/L某常用食品防腐剂、10g/L碳酸氢钠与10g/L抗坏血酸的混合液、对照液(蒸馏水)处理,4℃贮存并观察,记录数据如下图2:
依据文章回答下列问题。
(1)苹果褐变的过程属于____变化(填“物理”或“化学”)。
(2)碳酸氢钠的俗称是_____(填序号)。
A.食盐 B.纯碱 C.小苏打 D.苛性钠
(3)由图1可知,用____ g/L碳酸氢钠溶液处理对鲜切苹果的褐变、变软抑制的效果更好。
(4)由实验可知:抗坏血酸溶液与碳酸氢钠溶液混用效果更好,试推测可能的原因是:_________。
(5)根据文中的实验数据,你对储存苹果切片有哪些建议_________。
【题目】实验室有一瓶标签破损的硫酸。为测定该瓶硫酸溶液的溶质质量分数,小强同学在烧杯中加入50g该硫酸,然后向烧杯中滴加溶质质量分数为10%的氢氧化钠溶液,边滴加边搅拌,随着氢氧化钠溶液的滴入,溶液的pH变化情况如下表所示,请分析并计算:
氢氧化钠溶液的质量/g | 溶液的pH | 所得溶液 |
30 | pH<7 | a |
40 | pH =7 | b |
45 | pH>7 | c |
(1)a、b、c三种溶液中只含一种溶质的是________。
(2)该瓶硫酸溶液的溶质质量分数是多少____?(写出解题过程)(H2SO4+2NaOH==Na2SO4+2H2O)