题目内容
【题目】工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液),主要生产流程如图所示: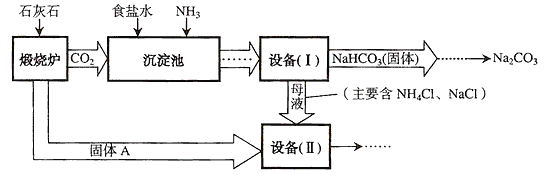
(已知2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O)
CaCl2+2NH3↑+2H2O)
(1)“煅烧炉”中发生反应的化学方程式是______________________。
(2)若在实验室里分离“设备(I)”中的混合物,用到的操作名称是__________。
(3)“沉淀池”中的反应是在加压的条件下不断向食盐水和饱和氨水溶液中通入二氧化碳气体,试分析该流程需要加压条件的原因是______。
(4)“设备(Ⅱ)”中固体A与水反应的化学方程式是______。
(5)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有_______________________(填写化学式)。
(6)请写出一个该生产流程的优点:___________________________。
【答案】 CaCO3高温CaO+CO2↑ 过滤 增大二氧化碳的溶解度 H2O+CaO===Ca(OH)2 NH3、NaCl 原料便宜易得(或者有物质可以循环利用)
【解析】(1)石灰石的主要成分是碳酸钙,在高温条件下发生分解反应生成氧化钙和二氧化碳气体。(2)通过过滤可将难溶性的固体与液体分离。(3)压强越大气体的溶解度越大。(4)“设备(Ⅱ)”中固体A是氧化钙,与水反应生成氢氧化钙。(5) NH3、NaCl是反应所用的原料。(6)该生产流程的优点是有的物质可以循环利用。

练习册系列答案
相关题目