题目内容
【题目】某同学向一定质量的硝酸银、硝酸铜和硝酸镁的混合溶液中逐渐加入锌粉,溶液质量与加入锌粉的质量关系如图所示。

(1)写出ab段发生反应的化学方程式。_______
(2)a点和c点溶液的质量相同,其原因是什么?_______
【答案】![]() 锌与硝酸银溶液反应时溶液质量减小,锌与硝酸铜溶液反应时溶液质量增大,ab段减小的质量和be段增大的质量相同,故a点和c点溶液质量相同
锌与硝酸银溶液反应时溶液质量减小,锌与硝酸铜溶液反应时溶液质量增大,ab段减小的质量和be段增大的质量相同,故a点和c点溶液质量相同
【解析】
(1)金属活动性为镁>锌>铜>银,因此加入锌粉后,锌与硝酸银先发生反应,锌与硝酸银反应生成硝酸锌和银,硝酸银相对分子质量大于硝酸锌相对分子质量,所以造成生成溶液减小,所以化学方程式为![]() ;
;
故答案为:![]() 。
。
(2)锌与硝酸银反应使溶液质量减小,而锌与硝酸铜反应生成了硝酸锌和铜,硝酸铜相对分子质量小于硝酸锌相对分子质量,所以又使溶液质量增加,因此ab段减小的质量与bc段增加的质量相等,使得a点与c点的形成溶液质量相等;
故答案为:锌与硝酸银溶液反应时溶液质量减小,锌与硝酸铜溶液反应时溶液质量增大,ab段减小的质量和be段增大的质量相同,故a点和c点溶液质量相同。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】某研究性学习小组对中和反应进行探究,请你参与实验。
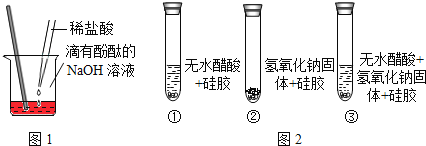
[探究活动1]证明酸和碱发生了反应。
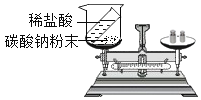
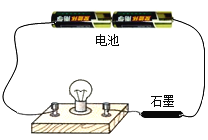
稀盐酸和NaOH溶液混合没有明显现象,小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是__________,反应的化学方程式________。
[探究活动2]能否通过证明有水生成来证明其反应的发生?
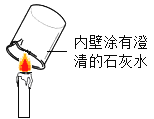
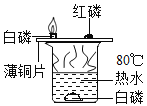
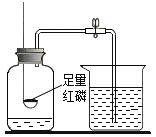
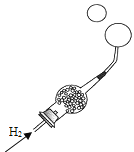
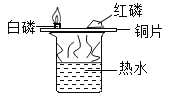
[设计实验]小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验,
[小资料]a变色硅胶吸水后由蓝色变为红色: b无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的实验目的是________。
(2)加入试剂后,要迅速塞紧橡胶塞的原因是_________。
(3)能证明酸和碱反应有水生成的现象是__________。
[探究活动3]能否通过测量酸和碱反应过程的pH、温度变化证明其反应的发生?取一定量的稀盐酸,连滴匀速滴加NaOH溶液,用电子传感器实时获得溶液的pH、温度曲线如图3.
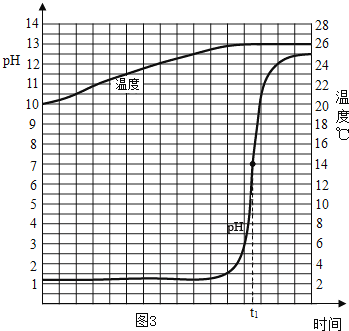
(4)由图3你得到的认识请写出两条:__________、_________。
(5)除了上述方法之外,还可以按照如下实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜。 | ______;_______ | _______;_______ |
【题目】(1)某同学用市售浓盐酸(溶质质量分数为37%,密度为1.18gmL-1)配制800g溶质质量分数为10%的稀盐酸。通过计算可知需要浓盐酸 mL,水(密度lgmL-1) mL(上述两空答案都精确到0.1mL)
(2) 长期使用的热水锅炉会产生水垢。水垢主要成分是碳酸钙和氢氧化镁。某兴趣小组为了测定水垢中CaCO3的含量,将6g水垢粉碎后放在烧杯中,然后向其中加入40g某浓度的稀盐酸,使之充分反应(水垢中除碳酸钙和氢氧化镁外都不与稀盐酸反应)。实验数据记录如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
烧杯内所盛物质的总质量/g | 46.0 | 45.2 | 44.8 | 45.1 | 44.1 | 43.9 | 43.8 | 43.8 |
①表中有一数据是不合理的,该数据的测得时间是第 min。
②根据以上数据计算水垢中CaCO3的质量分数(计算结果精确至 0.1%)。