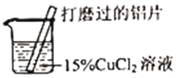题目内容
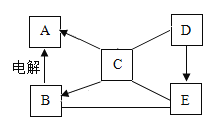
【题目】A、B、C、D、E是初中化学常见的物质,C是胃液中帮助消化的物质,D是大理石的主要成分。其相互反应情况如图所示,“一”表示物质之间能反应,“→”表示一种物质能一步转化成另一种物质。
(1)D生成E的化学方程式为_____;
(2)B与E的反应为_____(填“吸热”或“放热”)反应;
(3)写出A的一种用途_____。
【答案】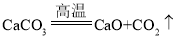 放热 做燃料(或者冶炼金属等)
放热 做燃料(或者冶炼金属等)
【解析】
A、B、C、D、E是初中化学常见的物质,C是胃液中帮助消化的物质,可推出C为盐酸,D是大理石的主要成分,可推出D为碳酸钙,B通过电解能生成A,盐酸能一步转化为A,可推出A是氢气,B是水,碳酸钙能一步转化为E,E能与盐酸、水反应,则E是氧化钙。
(1)D是碳酸钙,E是氧化钙,D生成E的化学方程式是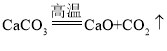 ;
;
(2)B是水,E是氧化钙,氧化钙与水的反应生成氢氧化钙是放热反应;
(3)A是氢气,氢气具有可燃性可作燃料或有还原性可以冶炼金属。

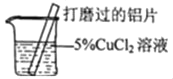
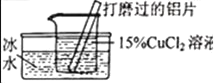
【题目】某化学兴趣小组的同学在实验室对铝与氯化铜溶液的反应进行了如下探究,请回答相关问题。
实验操作 | 实验现象 |
| ①有红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是_____。
(2)现象①③的红色物质为铜,生成铜的化学方程式为_____。
(3)收集逸出的无色气体,经检验具有可燃性,该气体为_____(写化学式),说明氯化铜溶液显_____性。
(查阅资料)氯化亚铜(CuC1)是一种微溶于水的白色固体,在空气中易被氧化成褐色的Cu(OH)Cl。
(4)取杯底的白色沉淀暴露在空气中,一段时间后观察到变成褐色,说明白色物质为氯化亚铜。该变色反应的产物只有 Cu(OH)Cl,反应的化学方程式为_____。
(发现问题)氯化亚铜的生成与反应条件有关吗?
(提出猜想)猜想I:与反应物的浓度有关;猜想Ⅱ:与反应的_____有关。
(实验探究)
实验设计 |
|
|
实验现象 | 有红色沉淀和无色气体生成,无白色沉淀生成。 | 有红色沉淀和无色气体生成,_____ |
实验结论 | 猜想I成立 | 猜想Ⅱ成立 |
(拓展与思考)氯化亚铜是否是反应生成的铜与溶液中的氯化铜发生 Cu+CuCl2=2CuCl反应生成的?可用试管取15%的氯化铜溶液,向其中加入_____并加热的方法来验证。