题目内容
小明和小芳在讨论“能否用蜡烛燃烧法来粗略测定空气中氧气的含量”这一问题时,小芳认为:通过图1装置,用蜡烛燃烧法测得的空气中氧气的含量会 (填“偏高”、“偏低”或“不变”)。她根据蜡烛燃烧产物的特点阐述了自己的理由: ,并用图1装置进行实验,证实了自己的结论。(注:本题实验中装置的气密性良好,水槽中的液体是水。)
小明认真分析了小芳的实验结果后,进行了如下探究:
【提出问题】导致小芳这一实验结果还有其他原因吗?
【实验探究】小明设计了图2装置,进行以下操作:
(1)取黄豆粒大小的白磷,用滤纸吸去表面的水分,放入捆在电烙铁下面贴片的凹槽内。
(2)将燃烧匙内的蜡烛点燃后迅速插入钟罩内,并立即塞紧橡皮塞。
(3)待蜡烛熄灭后(蜡烛有剩余),接通电烙铁电源,发现白磷先熔成液体,接着燃烧产生大量白烟,说明通电前钟罩内含有 ,产生白烟的文字表达式是 。
【得出结论】导致小芳这一实验结果的另一原因是 。
【交流与反思】小明和小芳分析了上述实验后,又提出了一个问题:能否用铁丝燃烧测定空气中氧气的含量,你的观点是 (填“能”或“否”),理由是
。
偏低 蜡烛燃烧产生二氧化碳气体
【实验探究】O2 磷+氧气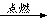 五氧化二磷
五氧化二磷
【得出结论】蜡烛没有将氧气全部消耗
【交流与反思】否 铁丝不能在空气中燃烧
解析试题分析:空气中氧气的含量是将氧气体积除以空气体积所得的百分数。但实验过程中氧气的体积到底有多少我们无法直观看到,只能是根据进入容器的水的体积来测定的。如果用蜡烛燃烧法来测定氧气的含量,由于蜡烛燃烧会产生二氧化碳气体,该气体大部分不溶于水,仍以气体形式存在于容器中,这就导致进入容器的水体积比正常情况下要少,即我们认为容器中的氧气比正常情况下少,测定出的氧气含量当然也就偏低了。
【实验探究】由于题中告诉我们白磷还能燃烧,所以容器中一定还存在氧气。反应的文字表达式为:磷+氧气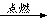 五氧化二磷。事实上,任何物质在氧气中燃烧,都有一个最低耗氧量的问题,当氧气含量低于该物质燃烧所需的最低氧气浓度的时候,该物质的燃烧就会停止。每种物质燃烧的最低耗氧量是不一样的,所以有些物质不能燃烧了,如本题中的蜡烛,但另一些物质却可继续燃烧,如本题中的磷。
五氧化二磷。事实上,任何物质在氧气中燃烧,都有一个最低耗氧量的问题,当氧气含量低于该物质燃烧所需的最低氧气浓度的时候,该物质的燃烧就会停止。每种物质燃烧的最低耗氧量是不一样的,所以有些物质不能燃烧了,如本题中的蜡烛,但另一些物质却可继续燃烧,如本题中的磷。
【得出结论】根据上述分析,我们不难得出本题答案:蜡烛没有将氧气全部消耗。
【交流与反思】题问:能否用铁丝燃烧测定空气中氧气的含量,事实上铁丝在空气中根本无法燃烧,怎么能谈得上燃烧法测定氧气含量呢!
考点:空气中氧气含量测定的原理分析及实验改进。

 名校课堂系列答案
名校课堂系列答案下列实验设计不能达到实验目的的是
| A.红磷燃烧测定空气中氧气的含量 | B.探究石蜡中含有氢、氧元素 |
| C.验证氢气的密度比空气小 | D.证明石墨具有导电性 |
如图所示的实验中,有一个实验没有利用到其他三个实验共同应用的一种研究方法,该实验是( )
A.验证使石蕊变色的物质是碳酸而不是二氧化碳 |
B.可燃物燃烧的条件 |
C.伏安法测电阻 |
| D.研究影响滑动摩擦力大小的因素 |
(15分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为 。
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 ; | 白色沉淀产生 | 该反应的化学方程式: ; |
| (2)将上述反应后的混合物过滤,取滤液加入 。 | 。 | 证明猜想Ⅱ正确 |
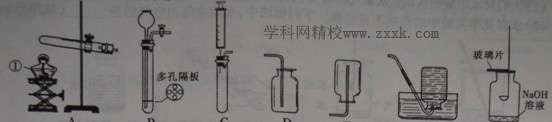
【实验探究2】小红同学设计如下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:
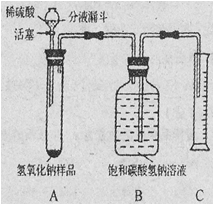
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是 ;
(2)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是 ;
(3)试管中原有的空气对实验结果是否有明显影响? (填“有”或“没有”)
(4)变质氢氧化钠样品中碳酸钠的质量分数为 。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
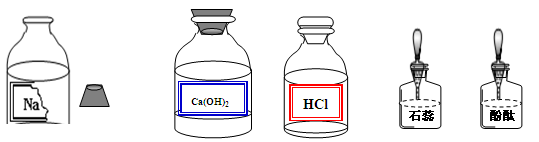
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如下图所示的实验流程。
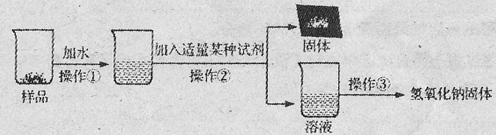
请回答下列问题:
(1)操作①、②、③的名称分别为 ,为了使样品充分溶解,操作①中还要用到的玻璃仪器是 ;
(2)该实验中发生反应的化学方程式为 ;
(3)最终所得氢氧化钠固体质量 变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有 (填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(2)实验探究Ⅰ中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,分别是 。