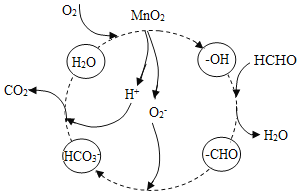
题目内容
【题目】甲和乙两种物质的溶解度曲线如图所示。下列叙述不正确的是
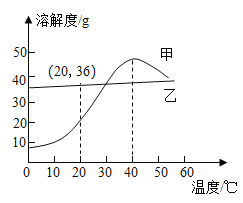
A.甲的溶解度随温度的升高而增大
B.40℃时,使甲的饱和溶液析出晶体可用加热升温的方法
C.20℃时,向125g溶质质量分数为20%的乙溶液中加入15g乙固体并振荡,有固体不溶解
D.将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量大
【答案】A
【解析】
A、通过分析溶解度曲线可知,小于40℃时,甲的溶解度随温度的升高而增大,故错误;
B、小于40℃时或大于40℃时,甲物质的溶解度随温度的升高时,溶解度都会减少,所以40℃时,使甲的饱和溶液析出晶体可用加热升温方法,故正确;
C、20℃时,乙物质的溶解度是36g,向125g溶质质量分数为20%的乙溶液中含有溶质质量为:125g×20%=25g,溶剂100g,加入15g乙固体并振荡,有固体不溶解,故正确;
D、将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲物质的溶解度变化最大,所以甲析出晶体的质量大,故正确。
故选A。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】化学课上老师演示在氢氧化钠溶液中滴加稀盐酸实验时,出现了有气泡产生的现象,同学们计划对产生该现象的原因进行探究。
(提出问题)产生的气体成分是什么?
(设计实验)将生成的气体通入澄清的石灰水,石灰水变浑浊。
(分析与讨论)①生成的气体是_____。
②氢氧化钠已变质,变质的原因用化学方程式表示为_____。
(进一步探究)氢氧化钠溶液变质的程度如何?
(实验方案)
方案1:取少量氢氧化钠溶液的样品于一洁净试管中,先滴加酚酞溶液,酚酞变红色,再滴加氯化钙溶液,出现白色沉淀。
方案2:取少量氢氧化钠溶液的样品于一洁净试管中,先滴加澄清石灰水,出现白色沉淀,静置,再在上层溶液中滴加酚酞溶液,酚酞变红色。
(分析与讨论)同学们认为以上两个方案都不正确。
方案1不正确的原因是_____。
方案2不正确的原因是_____。
经过讨论同学设计了以下方案,得到了合理的结论。
实验步骤 | 实验现象 | 实验结论 |
(1)取少量氢氧化钠溶液的样品于一洁净试管中,先滴加过量的氯化钙溶液,观察现象。 | _____ | 氢氧化钠部分变质 |
(2)再向其中滴几滴酚酞溶液。 | 酚酞变红色。 |
实验中滴加过量氯化钙溶液的目的是_____。
在氢氧化钠溶液中滴加稀盐酸,溶液温度与滴加稀盐酸质量之间的变化关系如图所示:
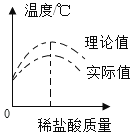
(1)实验中发现稀盐酸质量为m1时,测得的溶液温度最高,从能量的角度分析,氢氧化钠与稀盐酸的反应是_____反应;从反应进行的程度分析,温度达到最大值时,表示_____。随后溶液温度降低的原因是_____。
(2)实验数据分析可知测得的实际值低于理论值,请写出一点导致这种差异出现的原因_____。
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____。
(查阅资料)CaCl2溶液显中性。
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;猜想Ⅱ:有CaCl2和HCl;猜想Ⅲ:有CaCl2和Ca(OH)2;猜想Ⅳ:有CaCl2、HCl和Ca(OH)2。
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是_______。
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ①______ | ②_______ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想Ⅲ是正确的。
(评价反思)(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因:_____。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑____。
【题目】在一只烧杯中进行如图实验,补全实验报告:
序号 | 目的 | 步骤 | 现象与结论 |
① | 探究_______ | I 加入5mL1%NaOH稀溶液 II 滴加2滴酚酞试液 III 逐滴加入1%稀盐酸并搅拌 | 酚酞的作用是_______ |
② | 检验NaOH已变质 | I 加入少量样品 II 加入适量水溶液 III 加入_______ | 现象是_____ |
③ | 验证KCl不能无限溶解 | I 20℃时加入50g水 II 加入10gKCl并搅拌 III 至少加入_______ (已知:20℃,SKCl=34g/100g水) |
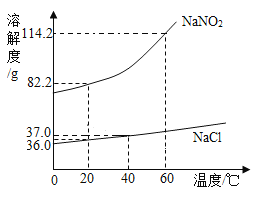
【题目】已知氯化钠和硝酸钾的溶解度如表:
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | |
(1)20℃时,氯化钠饱和溶液的溶质质量分数是_________________%.
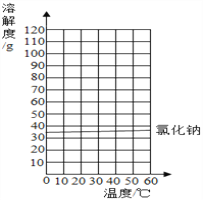
(2)请在如图中画出KNO3的溶解度曲线:图中两溶解度曲线交点的意义是________________
(3)KNO3是化学肥料中的___肥料,从热的KNO3浓溶液中析出晶体的方法是________________________ .