��Ŀ����
����Ŀ�����о���ͼ�Ļ�ѧ����ʱ��ͬѧ����֤����ϡH2SO4��NaOH��Һȷʵ�����˷�Ӧ������������һ�����ʵ�鷽����ơ�ʵʩ�����ۣ���ע����������Һ�����ԣ�
��1����NaOH��Һ�е���2��3�η�̪��Һ����Һ����ɫ��Ϊɫ�� 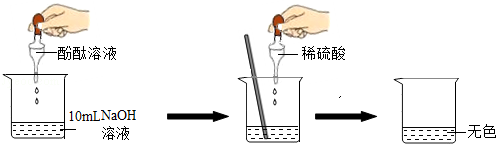
��2����������ʵ������ɫ�仯��ȷ��ϡH2SO4��NaOH��Һ�����˻�ѧ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ ��
��3����Ϊ��Һ�������ɫ��С��˵��ϡ����һ�������ˡ���С����ô˵�������� ��
��4��Ϊȷ��С�ֵ�˵���Ƿ���ȷ��ͬѧ�������������ʵ�鷽��������ʵ�飺
ʵ�鷽�� | ʵ�鲽�� | ʵ������ | ʵ����� |
����һ | ȡ���������������Ȼ�����Һ | ���ְ�ɫ���� | ϡH2SO4���� |
������ | ȡ��������2��3����ɫʯ����Һ | ��Һ��ɺ�ɫ | ϡH2SO4���� |
���������У�����Ϊ��ȷ�����������һ��������������
����һ��ʵ�鷽�������ԭ���û�ѧ����ʽ��ʾ���� ��
���������һ��ʵ�鷽��ȷ��ϡH2SO4��������ѡ������ҩƷ����
���𰸡�
��1����
��2��H2SO4+2NaOH�TNa2SO4+2H2O
��3������Һ����ʹ��̪��Һ��ɫ
��4����������BaCl2+Na2SO4�TBaSO4��+2NaCl������
���������⣺��1����NaOH��Һ�е���2��3�η�̪��Һ����Һ����ɫ���ɫ�� ����죮��2���������ƺ�ϡ���ᷴӦ���������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��H2SO4+2NaOH�TNa2SO4+2H2O��
���H2SO4+2NaOH�TNa2SO4+2H2O����3����Ϊ��Һ�������ɫ��С��˵��ϡ����һ�������ˡ���С����ô˵������������Һ����ʹ��̪��Һ��ɫ��
�������Һ����ʹ��̪��Һ��ɫ����4�����������У���ȷ���Ƿ�����������һ�����ԭ����ϡ������������Ʒ�Ӧ���ɵ��������ܺ��Ȼ�����Ӧ�������ᱵ�������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪ��BaCl2+Na2SO4�TBaSO4��+2NaCl��
����һ��ȷ��ϡH2SO4������ʵ�鷽���ǣ�ȡ�����������������ۣ��������ݣ�ϡ���������
�����������BaCl2+Na2SO4�TBaSO4��+2NaCl�����ۣ�
�����㾫���������кͷ�Ӧ����Ӧ�ú���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�ǽ����ĸ�������Ҫ֪���кͷ�Ӧ����������������κ�ˮ�ķ�Ӧ��ע�⣺a����ƽ b������ c�����ţ�

����Ŀ��һЩʳ��Ľ���pHֵ���£�����˵���в���ȷ����
���� | ƻ��֭ | ����֭ | ţ�� | ������ |
pH | 2.9-3.3 | 3.5-4.5 | 6.3-6.6 | 7.6-8.0 |
A. ����֭��ƻ��֭������ǿ B. ��������ʹ��ɫ��̪��Һ���
C. ţ�̺ͼ����嶼�ӽ����� D. θ��������Ӧ����ƻ��֭