题目内容
【题目】金属及其制品是现代生活中常见的材料,请回答下列问题:
(1)铁和铝都可以制作炊具,主要利用了它们的_____ (填 “导电”或“导热”)性。
(2)依据金属活动性顺序,可知人类对铝的利用要比铜和铁_____(填“早”或“晚”)得多。
(3)有X、Y、Z三种不同的金属,分别与硫酸铜溶液、稀硫酸反应,实验记录如下表(表中“√”表示能反应,“一” 表示不能反应)则X、Y、 Z三种金属元素活动性由强到弱的顺序是_____。
X | Y | Z | |
硫酸铜溶液 | √ | √ | |
稀硫酸 | √ |
(4)向硫酸亚铁和硫酸铜的混合溶液中加入一些锌粉, 充分反应后过滤。若向滤渣中滴加稀盐酸有气泡产生,则滤渣中一定含有的金属是_____,滤液中一定含有的溶质是_____。
(5)现有20g 赤铁矿石(其中杂质不参与反应)样品,用一氧化碳充分还原后,得到固体剩余物共15.5g,请计算该赤铁矿石中氧化铁的百分含量为_____。
【答案】导热 晚 Y >Z> X 铜、铁 硫酸锌 75%
【解析】
(1)铁和铝都可以制作炊具,主要利用了它们的导热性;
故填:导热。
(2)在金属活动性顺序里,位置越靠前的金属,活动性越强,冶炼就越困难,铝的利用要比铜和铁晚得多;
故填:晚。
(3)有X、Y、Z三种不同的金属,X不能与硫酸铜溶液、稀硫酸反应,说明X在铜的后面;Y能与硫酸铜溶液、稀硫酸反应,说明Y在氢的前面;Z能与硫酸铜溶液反应、不能与稀硫酸反应,说明Z在氢的后面,在铜的前面;则X、Y、 Z三种金属元素活动性由强到弱的顺序是Y >Z> X;
故填:Y >Z> X。
(4)向硫酸亚铁和硫酸铜的混合溶液中加入一些锌粉,有五种情况:
反应情况 | 滤渣成分 | 滤液中溶质 |
1、锌量少,与部分硫酸铜反应 | 铜 | 硫酸锌、硫酸亚铁、硫酸铜 |
2、锌量少,与硫酸铜恰好完全反应 | 铜 | 硫酸锌、硫酸亚铁 |
3、锌量少,与硫酸铜反应完与部分硫酸亚铁反应 | 铜、铁 | 硫酸锌、硫酸亚铁 |
4、锌量少,与硫酸铜、硫酸亚铁恰好完全反应 | 铜、铁 | 硫酸锌 |
5、锌过量,硫酸铜、硫酸亚铁反应完还有剩余 | 铜、铁、锌 | 硫酸锌 |
向滤渣中滴加稀盐酸有气泡产生,从上表可知,滤渣中一定含有铜、铁;滤液中一定含有的溶质是硫酸锌;
故填:铜、铁 硫酸锌
(5)一氧化碳还原氧化铁生成铁和二氧化碳,固体减少的质量就是氧化铁中氧元素的质量,即氧化铁中氧元素的质量为:20g-15.5g=4.5g,设氧化铁的质量为x,则:
![]()
X=15g
则赤铁矿石中氧化铁的百分含量为![]()
故填:75%。

 名校练考卷期末冲刺卷系列答案
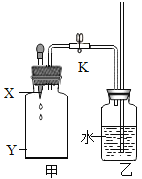
名校练考卷期末冲刺卷系列答案【题目】(探究一)利用如图所示的实验装置制备常见气体,请回答有关问题:
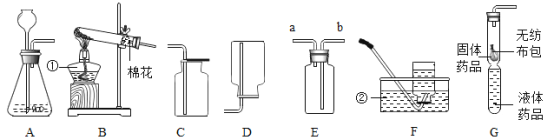
(1)写出标有序号的仪器名称:①___,②___。
(2)装置B为气体发生装置,在试管内放入一种暗紫色固体粉末制取氧气以制取氧气, 写出有关反应的文字或符号表达式___,收集装置为___。
(3)用装置E收集氧气,验满时将带火星的木条放在___(选填“a”或“b”)处。
(4)装置G是用软塑料管自制的气体发生装置,利用该装置也可以制取二氧化碳,塑料管中加入的液体药品是___,药品加入完毕后,要使反应进行,接下来的操作是:___,写出该反应的文字或符号表达式___
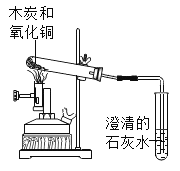
(探究二)探究氧化铁是否像二氧化锰一样可作氯酸钾分解的催化剂同学们设计了三组实 验(其他可能影响因素均控制相同):
实验编号 | 实验药品 | 分解温度(℃) |
实验④ | 1.2gKClO3 | T1 |
实验⑤ | 1.2gKClO3、0.5gMnO2 | T2 |
实验⑥ | 1.2gKClO3、0.5gFe2O3 | T3 |
(1)请写出氯酸钾在二氧化锰催化下制取氧气的文字或符号表达式:______。
(2)若T3___(选填“>”“=”或“<”)T1,说明氧化铁能加快氯酸钾的分解。
(3)若要比较氧化铁与二氧化锰对氯酸钾分解的催化效果,除了可以通过用比较T3与T2的大小,还可以通过排水法收集氧气,测量___进行比较,得出结论。
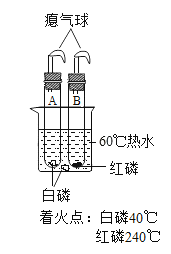
【题目】用如图所示装置,在常温下分别进行研究燃烧条件和研究氧气性质的实验。已知:白磷的着火点为40 ℃。
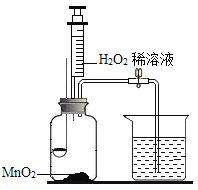
内容 | (实验1)研究燃烧的条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞。 | 烧杯中盛有澄清石灰水,燃烧匙中放入木炭,点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞。 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(1)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是________、__________。推入H2O2溶液后,观察到烧杯中的现象是____________。
(2)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,其反应化学方程式_______,由此得出氧气的性质是________;打开弹簧夹,还能观察到的现象是_______,其反应化学方程式________。木炭熄灭后冷却一段时间,烧杯中部分溶液流入集气瓶。
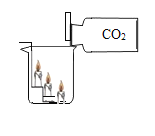
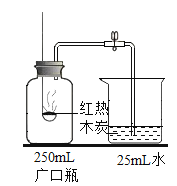
【题目】化学实验是培养化学素养的重要途径。根据以下实验回答问题:
A证明二氧化碳密度比空气大 | B 探究可燃物燃烧的两个条件 | C 测定空气中氧气的体积分数 | D 验证木炭能和氧化铜反应 |
|
|
|
|
(1)A 中观察到的现象是_____。
(2)B 中水的作用是隔绝空气和_____。
(3)C 中红热木炭和氧气反应的化学方程式为_____。
(4)D 中实验结束时,应先_____(选填“取出导管”或“停止加热”)。
(5)对不能达到目的的实验,你的改进措施是_____。