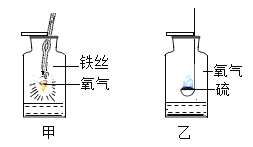
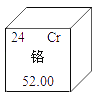
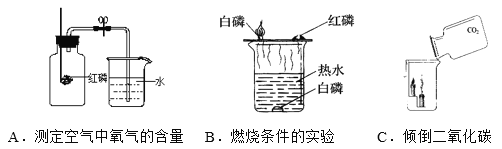
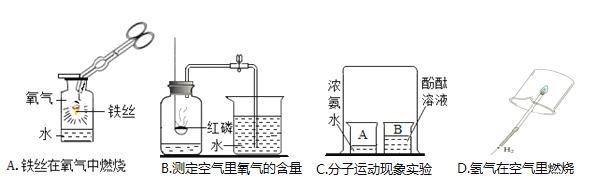
题目内容
【题目】现有碳酸钠和氯化钠的固体混合物13.4g,其中含碳元素1.2 g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到155 g氯化钠溶液。计算:
(1)原固体混合物中碳酸钠的质量分数_____(计算结果精确到0.1%);
(2)所用稀盐酸中溶质的质量分数_____。
【答案】79.1% 5.0%
【解析】
碳酸钠和氯化钠的固体混合物中含碳元素1.2 g,根据相对分子质量的计算,可计算出碳酸钠的质量。
解:设含碳元素1.2g的碳酸钠的质量为x
![]()
X=10.6g
(1)原固体混合物中碳酸钠的质量分数=![]() ;
;
故填:79.1%。
(2)设与10.6g碳酸钠反应的HCl的质量为y,生成CO2的质量为Z

![]()
![]()
Y=7.3g z=4.4g
所用稀盐酸的质量=155g+4.4g -13.4g=146g
所用稀盐酸中溶质的质量分数=![]()
故填:5.0%。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案【题目】金属及其制品是现代生活中常见的材料,请回答下列问题:
(1)铁和铝都可以制作炊具,主要利用了它们的_____ (填 “导电”或“导热”)性。
(2)依据金属活动性顺序,可知人类对铝的利用要比铜和铁_____(填“早”或“晚”)得多。
(3)有X、Y、Z三种不同的金属,分别与硫酸铜溶液、稀硫酸反应,实验记录如下表(表中“√”表示能反应,“一” 表示不能反应)则X、Y、 Z三种金属元素活动性由强到弱的顺序是_____。
X | Y | Z | |
硫酸铜溶液 | √ | √ | |
稀硫酸 | √ |
(4)向硫酸亚铁和硫酸铜的混合溶液中加入一些锌粉, 充分反应后过滤。若向滤渣中滴加稀盐酸有气泡产生,则滤渣中一定含有的金属是_____,滤液中一定含有的溶质是_____。
(5)现有20g 赤铁矿石(其中杂质不参与反应)样品,用一氧化碳充分还原后,得到固体剩余物共15.5g,请计算该赤铁矿石中氧化铁的百分含量为_____。