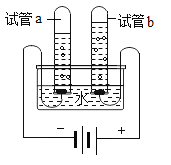
题目内容
【题目】铁及其化合物在生产生活中应用广泛。
(一)铁的性质和应用
(1)某麦片中含微量铁粉,食用后铁粉与胃酸(含HCl)反应转化为人体可吸收的铁元素,反应的化学方程式为_____________________;
(2)人体缺Fe2+影响健康(已知: Fe2+在空气中 易被氧化成Fe3+)。
①琥珀酸亚铁(化学式: FeC4H4O4)是常用补铁剂,其相对分子质量为_____________________;
②硫酸亚铁糖衣片亦能补铁,糖衣除包装药物外,另一作用是_____________________;高铁酸钾是高效杀菌净水剂,反应原理为: ![]() 。 x的化学式为_____________________;
。 x的化学式为_____________________;
(3)铁生锈的次要过程:
![]()
写出Fe转化为FeCO3总反应的化学方程式_____________________;
(4)为防止铁生锈,可对铁制品进行“烤蓝”处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21: 8)保护膜,该氧化物的化学式为_____________________;
(二)废铁的再利用
硫酸铁在农业可用作肥料,是花木,果树制造叶绿素的催化剂。用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备硫酸铁的主要流程如下:
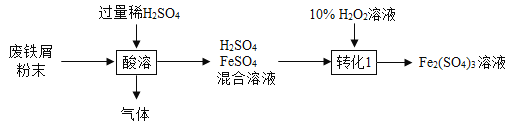
(1)将废铁屑研磨成粉末的目的是_____________________;
(2)“酸溶” 时H2SO4与FeCO3反应生成一种常见气体,反应的化学方程式为_____。
(3)“转化”过程中发生反应的化学方程式为_____________________。反应时温度不宜过高的原因是_____________________;
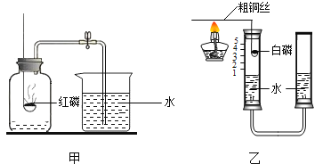
(三) CH4还原Fe2O3的探究
取40.0gFe2O3粉末,用下图装置进行实验,并对反应及产物等作探究。
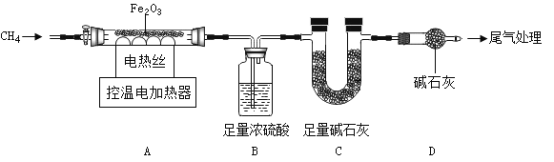
资料:①浓硫酸有吸水性,碱石灰可吸收H2O和CO2.②![]()
(I)装配好实验装置后,先要_____________________;
(2) A中反应:![]() 。下列说法正确的是_____________________;(选填序号)。
。下列说法正确的是_____________________;(选填序号)。
a x:y=1:2
b 装置B、C增加的质量比为9:11
(3)控温加热 一段时间后,继续通CH4至冷却,A中剩余的32.0g 固体为Fe和FeO的混合物。在剩余固体中加一定量稀硫酸溶液,反应刚好完全。
①剩余固体中FeO质量为_____________________g.
②剩余固体和稀硫酸完全反应形成FeSO4的质量为_____________________g.
【答案】![]() 172 隔绝氧气,防止亚铁离子被氧化 KOH
172 隔绝氧气,防止亚铁离子被氧化 KOH ![]() Fe3O4 增大反应物接触面积使充分反应,加快反应速率
Fe3O4 增大反应物接触面积使充分反应,加快反应速率 ![]()
![]() 减少过氧化氢的损耗 检查装置气密性 ab 18 76
减少过氧化氢的损耗 检查装置气密性 ab 18 76
【解析】
(一)(1)铁粉与胃酸(含HCl)反应,方程式为:![]() ;
;
(2)①琥珀酸亚铁(化学式: FeC4H4O4)是常用补铁剂,其相对分子质量=56+4×12+4×4+4×16=172,;②硫酸亚铁糖衣片亦能补铁,而Fe2+在空气中 易被氧化成Fe3+,因此糖衣除包装药物外,另一作用是防止亚铁离子被氧化;根据质量守恒定律,反应前后原子种类个数不改变,因此X的化学式为:KOH。
(3)Fe在氧气和二氧化碳及水共同作用下线产生水合物,然后脱水得到碳酸亚铁,因此转化为FeCO3总反应的化学方程式为:![]() 。
。
(4)元素质量比等于原子个数与相对原子质量乘积之比,设化学式中铁的原子个数为x,氧的原子个数为y,因此:![]() ,所以该氧化物的化学式为:Fe3O4。
,所以该氧化物的化学式为:Fe3O4。
(二)(1)将废铁屑研磨成粉末的目的是增大反应物接触面积,加快反应速率;
(2)“酸溶” 时H2SO4与FeCO3反应生成一种常见气体,则气体可能为CO2,反应的化学方程式为![]() ;
;
(3)转化前为硫酸与硫酸亚铁的混合物,但加入过氧化氢溶液后,产物为硫酸铁,因此化学方程式为:![]() 。若反应时温度过高,则可能发生过氧化氢分解为氧气和水的反应,因此不宜温度过高,减少过氧化氢的消耗;
。若反应时温度过高,则可能发生过氧化氢分解为氧气和水的反应,因此不宜温度过高,减少过氧化氢的消耗;
(三)(1)有气体参加反应,因此装配好实验装置后,先要检查装置气密性;
(2)反应前后原子个数不改变,因此根据氢原子的个数可知:4x=2y,因此x:y=1:2,a正确;又已知x和y的关系,因此每产生1个CO2,同时产生2个H2O,装置B目的是吸收水,C的目的是吸收CO2,因此BC增加的质量比应为:2×(2+16):(12+2×16)=9:11,因此b也正确,故选ab。
(3)由于反应前有40g固体,其中Fe元素的质量为:![]() ,反应后剩余32.0g,因此氧元素的质量为:32.0-28=4g,①设FeO的质量为m:
,反应后剩余32.0g,因此氧元素的质量为:32.0-28=4g,①设FeO的质量为m:![]() ,m=18g,故FeO的质量为18g。②已知Fe质量为28g,加入硫酸后恰好反应完全,因此生成的FeSO4中Fe元素质量守恒,即也为28g,因此设硫酸亚铁的质量为m1:则
,m=18g,故FeO的质量为18g。②已知Fe质量为28g,加入硫酸后恰好反应完全,因此生成的FeSO4中Fe元素质量守恒,即也为28g,因此设硫酸亚铁的质量为m1:则![]() ,m1=76g,故生成的硫酸亚铁质量为76g。
,m1=76g,故生成的硫酸亚铁质量为76g。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
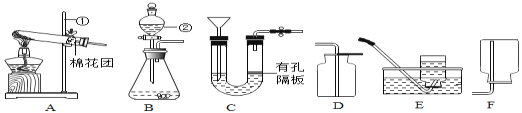
周周清检测系列答案【题目】根据如图回答问题。

(1)仪器a的名称是________________;
(2)实验室制取二氧化碳的发生和收集装置是_________________;发生反应的化学方程式为_____________;若该实验需要制取44g二氧化碳,实验室只有100g 大理石和足量稀盐酸,请通过计算说明能否完成实验任务? _________________;
(3)实验室用A装置制氧气的化学方程式为__________________。装置E中的实验现象是____________________;发生反应的化学方程式为___________________。
(4)探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如表所示。
氧气体积分数(%) | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
在集气瓶中注入占其容积50%的水(如图F所示),用排水法收集完氧气后,将带火星的木条伸入该集气瓶中,推测实验现象为_________________。