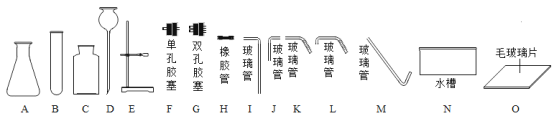
题目内容
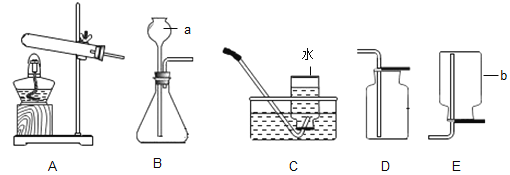
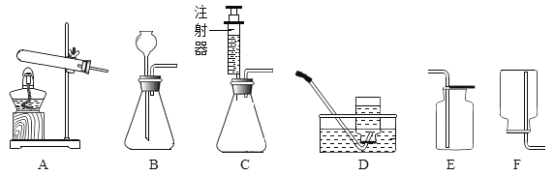
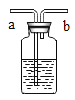
【题目】下图是“空气中氧气体积分数测定”实验的两种装置图。甲图的集气瓶容积为200mL,预先装进50mL的水;乙图是对甲实验的改进,加热粗铜丝白磷即被点燃(白磷的燃点为40℃,燃烧产物与红磷相同)
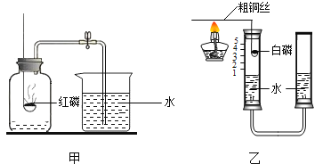
(1)该实验中红磷燃烧的现象____。若用甲图进行实验,获得成功最终集气瓶中水的体积约为__mL;该实验还可推知出氮气性质有____(任写一点)
(2)集气瓶里预先装进的50mL水,在实验过程中所起的作用____(填序号)
A 加快集气瓶内气体冷却 B 液封导气管末端以防气体逸出 C 吸收五氧化二磷
(3)与甲比较乙装置的好处____(写一点)。
白磷燃烧的文字表达式或符号表达式____。
【答案】放热,产生大量白烟 80mL 氮气难溶于水或氮气既不燃烧也不支持燃烧 AC 更加环保或操作更简便或实验更准确 磷+氧气![]() 五氧化二磷,P+O2
五氧化二磷,P+O2![]() P2O5
P2O5
【解析】
(1)红磷燃烧的现象是产生白烟,放热;由于消耗氧气的体积约为空气体积的![]() ,故最终集气瓶中水的体积约为(200mL-50mL)×
,故最终集气瓶中水的体积约为(200mL-50mL)×![]() +50mL=80mL;实验还可推知出氮气性质是不溶于水,不能燃烧,不支持燃烧。
+50mL=80mL;实验还可推知出氮气性质是不溶于水,不能燃烧,不支持燃烧。
(2)集气瓶内预先装入适量的水,可以加快集气瓶冷却,缓冲集气瓶内气压的骤然升高,并吸收五氧化二磷,防止污染空气。故选AC。
(3)与甲比较乙装置的好处是装置始终密闭,误差较小;白磷燃烧生成五氧化二磷,白磷燃烧的文字表达式磷+氧气![]() 五氧化二磷,符号表达式P+O2
五氧化二磷,符号表达式P+O2![]() P2O5。
P2O5。

【题目】学习了MnO2可催化过氧化氢溶液分解制取氧气后,某同学猜想Al2O3 能否起到类似MnO2的催化作用呢?于是进行了以下探究。
[猜想与假设]
猜想1:Al2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变;
猜想2:Al2O3参与反应并产生O2,反应前后质量和化学性质发生了改变;
猜想3:Al2O3是反应的催化剂,反应前后_____。
[实验设计]用天平称量Al2O3 0.2 g,取5 mL 5%的过氧化氢溶液于试管中,进行如下实验:
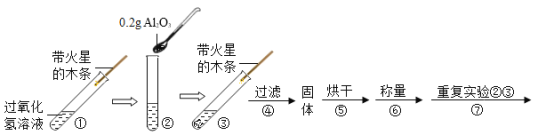
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
溶液中有气泡放出带火星的木条复燃 | 称量Al2O3的质量仍为0.2 g | 溶液中有大量气泡放出_____, | 猜想3成立 |
(2)步骤①③的目的是_____。
(3)写出Al2O3 催化过氧化氢溶液分解产生氧气的文字表达式:_____。
[继续探究]氧化铝是否比二氧化锰的催化效果更好?
小雨以生成等体积的氧气为标准,设计下列三组实验(其他可能影响实验的因素均忽略):
实验序号 | 5%过氧化氢溶液体积 | 催化剂种类及质量 | 待测数据 |
① | 5 mL | ||
② | 5 mL | 0.5 g Al2O3 | |
③ | 5 mL | 0.5gMnO2 |
(4)上述实验测量的“待测数据”是_____。
(5)若测得实验②的数据比实验③的数据大
[实验反思]
(6)影响过氧化氢溶液分解产生氧气快慢的因素还可能有:_____(写两种)。
(7)请设计实验验证你的其中一种猜想:_____。