题目内容
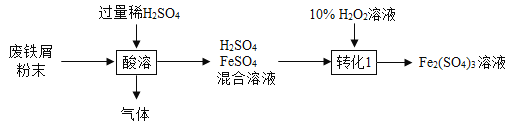
【题目】小明同学想在实验室完成模拟炼铁的实验,设计下图①→④的思路。已知方框内是初中常见气体制取的发生装置,可供选择的装置见图A或B,提供选择的药品是:氯酸钾晶体、过氧化氢溶液、二氧化锰粉末、稀盐酸、块状石灰石

(1)写出图中标号a、b、c的仪器名称: a是______,b是_______,c是_______;
(2)若用A装置放入①方框内,则X是氧气,写出生成氧气的化学方程式_______;
(3)若用B装置放入①方框内,且能控制反应发生与停止,则X气体______(填能或不能)是氧气,写出生成X气体的化学方程式_____;
(4)③中玻璃管内固体由____色逐渐变成___色,说明氧化铁与一氧化碳反应生成了铁,该化学方程式为______,该反应______(填属于或不属于)置换反应;
(5)④中试管内出现白色浑浊,该化学方程式为_____;④中尾气处理的化学方程式为______。
【答案】铁架台 酒精喷灯 长颈漏斗 2KClO3![]() 2KCl+3O2↑ 不能 CaCO3+2HCl=CaCl2+H2O+CO2↑ 红棕 黑 Fe2O3 +3CO
2KCl+3O2↑ 不能 CaCO3+2HCl=CaCl2+H2O+CO2↑ 红棕 黑 Fe2O3 +3CO![]() 2Fe+3CO2 不属于 Ca(OH)2+CO2=CaCO3↓+H2O 2CO+O2
2Fe+3CO2 不属于 Ca(OH)2+CO2=CaCO3↓+H2O 2CO+O2![]() 2CO2
2CO2
【解析】
氯酸钾和二氧化锰加热生成氯化钾和氧气,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,一氧化碳和氧化铁高温生成铁和二氧化碳,二氧化碳和氢氧化钙生成碳酸钙和水,一氧化碳点燃生成二氧化碳。
(1)图中标号a、b、c的仪器名称: a是铁架台,b是酒精喷灯,c是长颈漏斗。
(2)A装置试管口没有棉花,若用A装置放入①方框内,则X是氧气,生成氧气的反应是氯酸钾和二氧化锰加热生成氯化钾和氧气,反应的化学方程式为2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
(3)B装置含有多孔塑料板,多孔塑料板上面放的是块状固体,若用B装置放入①方框内,且能控制反应发生与停止,则X气体不能是氧气,生成X气体的反应是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑。
(4)③中反应是一氧化碳和氧化铁高温生成铁和二氧化碳,故玻璃管内固体由红棕色逐渐变成黑色,说明氧化铁与一氧化碳反应生成了铁,该化学方程式为Fe2O3 +3CO![]() 2Fe+3CO2,置换反应是一种单质和一种化合物生成另一种单质和另一种化合物,故该反应不属于置换反应。
2Fe+3CO2,置换反应是一种单质和一种化合物生成另一种单质和另一种化合物,故该反应不属于置换反应。
(5)④中试管内出现白色浑浊,反应是二氧化碳和氢氧化钙生成碳酸钙和水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;④中尾气是一氧化碳,一氧化碳点燃生成二氧化碳,故处理的化学方程式为2CO+O2![]() 2CO2。
2CO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】学习了MnO2可催化过氧化氢溶液分解制取氧气后,某同学猜想Al2O3 能否起到类似MnO2的催化作用呢?于是进行了以下探究。
[猜想与假设]
猜想1:Al2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变;
猜想2:Al2O3参与反应并产生O2,反应前后质量和化学性质发生了改变;
猜想3:Al2O3是反应的催化剂,反应前后_____。
[实验设计]用天平称量Al2O3 0.2 g,取5 mL 5%的过氧化氢溶液于试管中,进行如下实验:
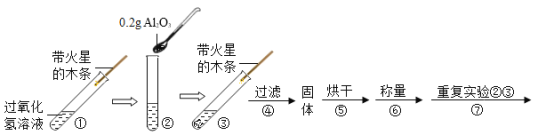
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
溶液中有气泡放出带火星的木条复燃 | 称量Al2O3的质量仍为0.2 g | 溶液中有大量气泡放出_____, | 猜想3成立 |
(2)步骤①③的目的是_____。
(3)写出Al2O3 催化过氧化氢溶液分解产生氧气的文字表达式:_____。
[继续探究]氧化铝是否比二氧化锰的催化效果更好?
小雨以生成等体积的氧气为标准,设计下列三组实验(其他可能影响实验的因素均忽略):
实验序号 | 5%过氧化氢溶液体积 | 催化剂种类及质量 | 待测数据 |
① | 5 mL | ||
② | 5 mL | 0.5 g Al2O3 | |
③ | 5 mL | 0.5gMnO2 |
(4)上述实验测量的“待测数据”是_____。
(5)若测得实验②的数据比实验③的数据大
[实验反思]
(6)影响过氧化氢溶液分解产生氧气快慢的因素还可能有:_____(写两种)。
(7)请设计实验验证你的其中一种猜想:_____。
【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
充分溶解后 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液溶质质量分数为10%B.实验说明25℃时该物质的溶解度是20
C.实验③④所得溶液溶质质量分数相同D.实验④所得溶液中含溶质20g