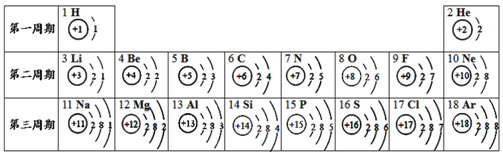题目内容
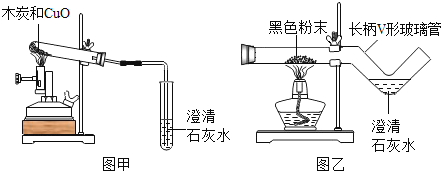
【题目】我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动
(提出问题)木炭与CuO反应所得红色固体中含有什么物质?
(查阅资料)(1)木炭与CuO的反应是:C+2CuO![]() 2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4====Cu+CuSO4+H2O
(作出猜想)红色固体的成分:①全部是Cu;②全部是Cu2O;③_______________.
(实验探究)
(1)取木炭、CuO两种黑色粉末适量,再加少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,____________,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水_______________,此时停止加热。
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
步骤 | 现象 | 结论 |
①取2.88g红色固体装入试管,滴入足量 的_______________,充分反应 | 红色固体部分减少,溶液变 为_______________色 | 猜想____错误 |
②滤了试管中残留的红色固体,洗涤干燥 称其质量为2.08g | 猜想____正确 |
(评价反思)
(1)使用图乙装置与使用图甲装置相比,其优点是_______________(写出1条即可);
(2)要证明氯化钙CaCl2是催化剂还需要验证CaCl2反应前后__________________不变.
(拓展提高)
我们生活中的铜有一部分是由辉铜矿(主要成分为硫化亚铜(Cu2S))的矿石冶炼而成,经测定该矿石由硫化亚铜(Cu2S)和其他不含铜元素的物质组成.现用100g该矿石制得2.16g纯氧化亚铜(Cu2O),该纯氧化亚铜(Cu2O)中铜元素的质量是__________g.若制得氧化亚铜(Cu2O)的过程中,铜元素的总损耗为20%,通过计算确定该矿石中硫化亚铜(Cu2S)的质量分数_________?(请写出计算过程).
【答案】 Cu和 Cu2O的混合物 加石灰水 , 变浑浊 ; 稀盐酸或稀硫酸 , 蓝 , ① ; ③ ; 节约药品(合理即可) ; 质量和化学性质 ; 1.92 g. 3%
【解析】【作出猜想】红色固体可能是Cu和Cu2O的混合物;
【实验探究】
(2)固体药品装好后,再向V型管中加入液体澄清石灰水;碳与氧化铜反应有二氧化碳气体生成,故澄清石灰水变浑浊;
(3)向红色固体中加入某物质后,红色固体部分减少,故加入的是酸,稀硫酸或稀盐酸;红色部分减少是由于稀硫酸与氧化亚铜反应生成硫酸铜和铜等物质,故溶液变为蓝色;可以得出红色固体可能是铜和氧化亚铜的混合物,也可能是氧化亚铜,故猜想①错误;假设2.88g的红色固体全部是氧化亚铜,生成铜的质量为x
Cu2O+H2SO4====Cu+CuSO4+H2O
144 64
2.88g x
![]() =
=![]() ,解得x=1.38g,最终称得红色固体的质量为2.08g,故原红色固体中有铜,故猜想③正确;
,解得x=1.38g,最终称得红色固体的质量为2.08g,故原红色固体中有铜,故猜想③正确;
【评价反思】
(1)图乙装置与图甲装置相比较的优点是操作简便,节约药品;、
(2)催化剂在反应前后的质量和化学性质不变,故要证明氯化钙是该反应的催化剂还需要证明氯化钙在反应前后的质量和化学性质没有变化;
【拓展提高】
2.16g纯氧化亚铜(Cu2O)中铜的质量为2.16g×![]() =1.92g;
=1.92g;
1.92÷(1-20%)=2.4g
含铜2.4g的硫化亚铜的质量为2.4g÷![]() =3g
=3g
故100g样品中硫化亚铜的质量分数为3g÷100g×100%=3%。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】元素周期表是学习和研究化学的重要工具,可以从表中获得许多知识。图A(见下表)是元素周期表的一部分;图B和图C 是元素周期表中两种元素的原子结构示意图。请你根据图表回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
第二 周期 | 3 Li 锂 7 | 4 Be 铍 9 | …… | 5 B 硼 11 | ① | 7 N 氮 14 | 8 O 氧 16 | 9 F 氟 19 | 10 Ne 氖 20 |
第三 周期 | 11 Na 钠 23 | ② | …… | 13 Al 铝 27 | 14 Si 硅 28 | ③ | 16 S 硫 32 | 17 Cl 氯 35.5 | 18 Ar 氩 40 |

(1)从图A中找出原子序数为16的元素名称为_______;
(2)图C是某元素的原子结构示意图,该原子在化学反应中易______电子;
(3)图B是某元素的原子结构示意图,该元素在图A中的位置是______(选填①、②或③)。