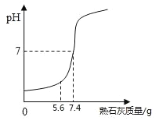
题目内容
【题目】元素周期表是化学学习的重要工具,依据下表回答问题:
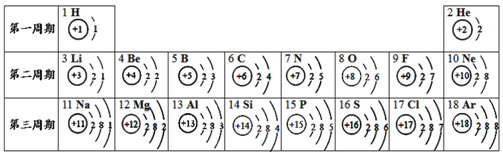
(1)表中14号元素的化学性质与_____________元素相似;
(2)通过上表的分析可知:元素所在的周期数=该元素原子核外的_____________;
(3)在化学反应中,铝原子失电子形成铝离子,写出铝离子符号_____________;
(4)钠元素与氧元素形成的化合物化学式为_____________。
【答案】 碳(C) 电子层数 Al3+ Na2O
【解析】本题考查了元素周期表的特点及其应用,原子结构示意图与离子结构示意图。
(1)元素的化学性质与原子的最外层电子数的关系密切。14号元素是硅元素,其最外层电子数与碳元素(C)均为4,化学性质相似;
(2)通过上表的分析可知:元素所在的周期数和该元素原子核外的电子层数相同;
(3)铝原子最外层有3个电子,在化学变化中易失去最外层的3个电子,形成带上三个单位正电荷的离子,铝离子符号是Al3+;
(4)钠元素最外层电子数是1,容易失1个电子,带1个单位正电荷,显+1价;氧元素最外层电子数是6,容易得2个电子,带2个单位负电荷,显-2价,正价在前,负价在后,化学式是Na2O。

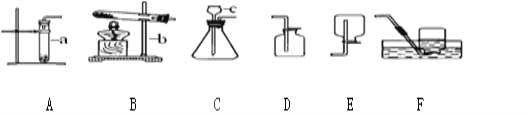
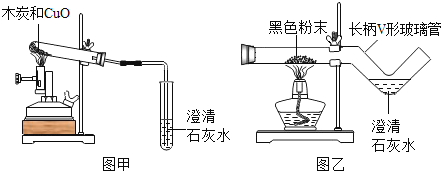
【题目】我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动
(提出问题)木炭与CuO反应所得红色固体中含有什么物质?
(查阅资料)(1)木炭与CuO的反应是:C+2CuO![]() 2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4====Cu+CuSO4+H2O
(作出猜想)红色固体的成分:①全部是Cu;②全部是Cu2O;③_______________.
(实验探究)
(1)取木炭、CuO两种黑色粉末适量,再加少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,____________,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水_______________,此时停止加热。
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
步骤 | 现象 | 结论 |
①取2.88g红色固体装入试管,滴入足量 的_______________,充分反应 | 红色固体部分减少,溶液变 为_______________色 | 猜想____错误 |
②滤了试管中残留的红色固体,洗涤干燥 称其质量为2.08g | 猜想____正确 |
(评价反思)
(1)使用图乙装置与使用图甲装置相比,其优点是_______________(写出1条即可);
(2)要证明氯化钙CaCl2是催化剂还需要验证CaCl2反应前后__________________不变.
(拓展提高)
我们生活中的铜有一部分是由辉铜矿(主要成分为硫化亚铜(Cu2S))的矿石冶炼而成,经测定该矿石由硫化亚铜(Cu2S)和其他不含铜元素的物质组成.现用100g该矿石制得2.16g纯氧化亚铜(Cu2O),该纯氧化亚铜(Cu2O)中铜元素的质量是__________g.若制得氧化亚铜(Cu2O)的过程中,铜元素的总损耗为20%,通过计算确定该矿石中硫化亚铜(Cu2S)的质量分数_________?(请写出计算过程).