题目内容
【题目】图示流程进行“燃煤烟气的脱硫研究”实验中,SO2和O2的混合气体连续通入,水和铁在起始时一次性加入,反应液多次循环。下列说法正确的是

A. 吸收液的主要成分是H2SO4
B. 该流程的研究对减缓“温室效应”有积极的意义
C. 反应液可以用来制备FeSO47H2O,它在医疗上常用于治疗佝偻病
D. 反应液流入Ⅰ中,反应速率明显加快,可能是反应液有催化作用
【答案】AD
【解析】A、二氧化硫和氧气和水反应生成了硫酸,故溶质是硫酸,正确;
B、该实验是研究二氧化硫的实验,故对酸雨有积极的意义,错误;
C、佝偻病是由于缺钙引起的,与FeSO4无关,错误;
D、反应液流入Ⅰ中,反应速率明显加快,可能是由于亚铁离子对亚硫酸氧化成硫酸的反应起催化作用,正确,故选AD。

【题目】铝合金是工业中应用最广泛的一类有色金属结构材料,在航空、航天、汽车、机械制造、 船舶及化学工业中已大量应用。工业经济的飞速发展,对铝合金的需求日益增多,使铝合金的研究也随之深入。已知某铝合金粉末除铝外,还含有铁、铜中的一种或两种。某兴趣小组在老师的指导下,对铝合金粉末中铁、铜的存在情况进行了探究。
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水); Fe、Cu不与氢氧化钠溶液反应。
猜想1:该合金粉末中除铝外,还含有铁。
猜想2:该合金粉末中除铝外,还含有铜。
猜想3:该合金粉末中除铝外,还含有铁、铜。
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液。
实验方案 | 实现现象 | 结论 |
①取一定量的合金粉末,加过量的___________,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有________ 。 |
②取步骤①所得滤渣,加过量的___________,充分反应。 | 滤渣部分溶解,并有气体放出,溶液呈浅绿色。 | 合金中一定含有_________。 |
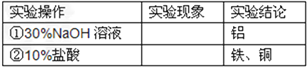
【探究结论】猜想 _________成立。
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与稀盐酸反应的化学方程式 ___________________。
【拓展与分析】
为了验证铝、铁的金属活动性强弱,小刘同学设计了如下实验方案:把表面积相同的铝丝和铁片同时投入到相同体积的稀盐酸中,比较反应的剧烈程度。请你评价该方案在操作过程中和控制变量上的不足之处。
操作过程中的不足之处___________________。
控制变量上的不足之处________________________。
请你再设计一种不同类型的实验方案,验证铝、铁的金属活动性强弱。________________。