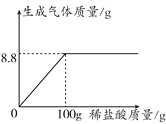
题目内容
【题目】钇(Y)是一种稀土元素,该元素在元素周期表中的信息如图所示。下列有关说法错误的是( )
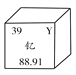
A. 钇属于金属元素
B. 钇原子中的质子数为39
C. 钇元素的相对原子质量为88.91
D. 钇原子中的中子数为39
【答案】D
【解析】A、根据元素周期表中的一格中获取的信息,该元素的名称是钇,属于金属元素,正确;B、根据元素周期表中的一格中获取的信息,该元素的原子序数为39;根据原子序数=核电荷数=质子数,则钇原子的质子数为39,正确;C、根据元素周期表中的一格中获取的信息,可知元素的相对原子质量为88.91,正确;D、根据元素周期表中的一格中获取的信息,该元素的原子序数为39;根据原子序数=核电荷数=质子数,则钇原子的质子数为39,而不是中子数为39,错误。故选D。

【题目】某校研究性学习小组的同学设计了一个对比实验,探究物质溶于水时是放出热量还是吸收热量。向下图A、B、C三个实验装置中盛有一定量水的小试管里依次加入固体NaCl、NH4NO3、NaOH(加入固体物质之前,三个实验装置中U形管两端的液面持平)。
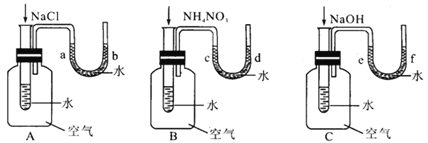
(1)请你帮他们填写下表。
A | B | C | |
现象 | ___________ | ____________ | ___________ |
原因 | __________ | ____________ | ____________ |
(2)从上述物质溶解于水的对比实验中你得出的初步结论是______________。
【题目】电池是日常必备用品之一,但它也是环境污染的一个重要来源。是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
(知识储备)
(1)锌锰电池的构造和组成。
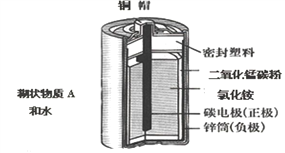
(2)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾晶体(CuSO4 5H2O)受热时可失去结晶水变为白色的无水硫酸铜粉末(CuSO4)。
I.制备皓矾晶体(ZnSO4xH2O)
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如下图:
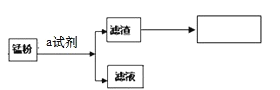
﹙1﹚流程图中试剂a的化学式是____________;得到的滤液1农业上可用作_____________。
﹙2﹚将滤渣B在空气中充分灼烧 可提纯制得的固体是____,该方法提纯的原理是(用化学方程式回答)______。
﹙3﹚将滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系如下表,
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
将滤液2蒸发浓缩、_______________,可得到皓矾晶体(ZnSO4xH2O)。
II.皓矾晶体中结晶水含量的测定
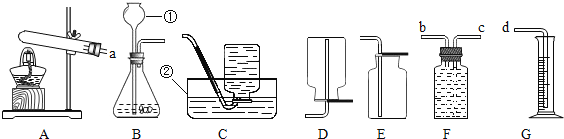
小组同学将部分皓矾晶体(ZnSO4xH2O)带回实验室,用下图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。

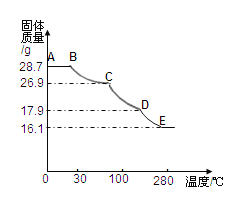
测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:(ZnSO4xH2O ==ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
⑷A中的化学方程式是____________,B中的试剂可从下列物质中选取,你的选择是_____
A.浓硫酸 B.硝酸银溶液 C.饱和碳酸钠溶液 D.澄清石灰水
⑸实验过程中若不通入CO2测得的结果将________(填“偏大”、 “偏小”或“无影响”)。根据实验结果,计算皓矾晶体中结晶水的x值为________。计算过程_____________。
⑹将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如下图,写出D-E段发生反应的化学方程式______________ 。