题目内容
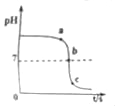
【题目】为测定某硫酸溶液的溶质质量分数,某同学取10g样品,逐滴加入溶质质量分数为5%的NaOH溶液,边加边搅拌,溶液pH的变化如图所示.请回答下列问题:
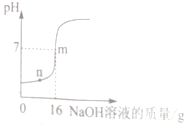
﹙1﹚n点所对应的溶液中所含阴离子符号;
﹙2﹚图中m点所消耗氢氧化钠溶液中溶质的质量;
﹙3﹚计算该硫酸的溶质质量分数(请写出计算过程)。
【答案】(1)SO42- ;(2)0.8;(3)9.8%
【解析】溶液的pH=7时,硫酸与氢氧化钠恰好反应。﹙1﹚n点溶液显酸性,硫酸剩余,所对应的溶液中所含的阴离子是SO42-。﹙2﹚m点消耗NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g﹙3﹚设该硫酸的溶质质量分数为x。
2NaOH + H2SO4 ==Na2SO4 + 2H2O
80 98
0.8g 10g×x
![]() =
=![]() ,解得x=9.8%
,解得x=9.8%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目