题目内容
【题目】学习化学离不开实验
(1)在实验课上,老师要同学们配制15%的氯化钠溶液50 g。
①计算:配制15%的氯化钠溶液50 g,需氯化钠的质量为_____________g。
②甲同学按下图所示步骤依次操作。
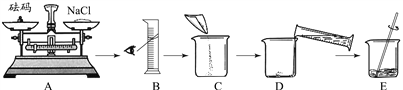
其错误的操作步骤有_______(填字母序号);E中玻璃棒的作用是_________________。
③乙同学在将称量好的氯化钠倒入烧杯时,有一部分氯化钠固体撒出,则所配溶液溶质质量分数与15%相比___________(填“偏低”、“偏高”、或“相等”)
(2)请根据下图装置,回答相关问题:
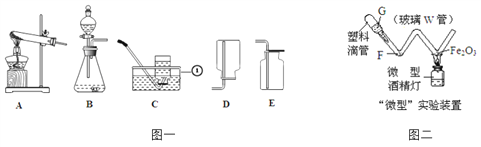
①写出图一中标号①的仪器名称:____________。
②实验室用过氧化氢溶液制取O2,可选用的发生装置为______(填写图一中装置序号)。
③小红想利用A装置通过加热高锰酸钾制氧气,此发生装置中还缺少的一种实验用品是______________。加热高锰酸钾制氧气的反应方程式为:_____________________。
④图二为某种“微型”实验装置。如果G处装稀盐酸,F处放少量锌粒,进行氢气还原氧化铁的实验;写出用“微型”装置进行该实验具有的一个优点:_____________。
【答案】 7.5 AB 搅拌,加快溶解 偏低 水槽 B 棉花 2KMnO4![]() K2MnO4 + MnO2 + O2↑ 节约药品用量或减少污染(合理即可)
K2MnO4 + MnO2 + O2↑ 节约药品用量或减少污染(合理即可)
【解析】(1)①50g 15%的氯化钠溶液中氯化钠的质量=50g×15%=7.5g;②错误的操作步骤有 A,没有按照左物右码的规定称量药品,B没有平视凹液面的最低处;E中玻璃棒的作用是搅拌,加速溶解;③配制溶液过程中,溶质损失,溶液的溶质质量分数会减小;(2)
根据实验室常用仪器可知:①是水槽;②实验室用过氧化氢溶液制取O2,属于固液常温型,故选B;③加热高锰酸钾制氧气,为防止高锰酸钾随气流进入导气管,试管口应放一团棉花;加热高锰酸钾制氧气的反应方程式为: ![]()
![]()
![]() ;④锌和硫酸反应生成氢气,氢气具有还原性,还原氧化铁时,红色会变成黑色;实验装置改进的优点是:节约药品、比较环保、安全等。
;④锌和硫酸反应生成氢气,氢气具有还原性,还原氧化铁时,红色会变成黑色;实验装置改进的优点是:节约药品、比较环保、安全等。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案【题目】电池是日常必备用品之一,但它也是环境污染的一个重要来源。是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
(知识储备)
(1)锌锰电池的构造和组成。
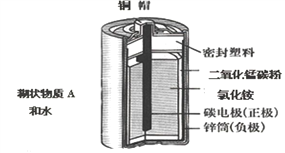
(2)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾晶体(CuSO4 5H2O)受热时可失去结晶水变为白色的无水硫酸铜粉末(CuSO4)。
I.制备皓矾晶体(ZnSO4xH2O)
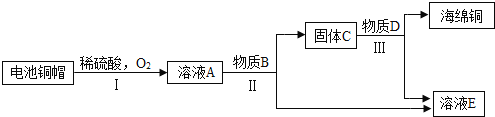
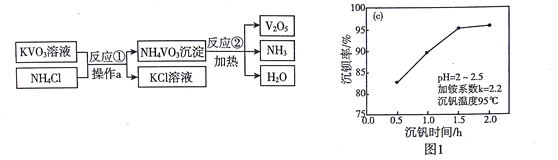
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如下图:
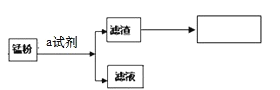
﹙1﹚流程图中试剂a的化学式是____________;得到的滤液1农业上可用作_____________。
﹙2﹚将滤渣B在空气中充分灼烧 可提纯制得的固体是____,该方法提纯的原理是(用化学方程式回答)______。
﹙3﹚将滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系如下表,
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
将滤液2蒸发浓缩、_______________,可得到皓矾晶体(ZnSO4xH2O)。
II.皓矾晶体中结晶水含量的测定
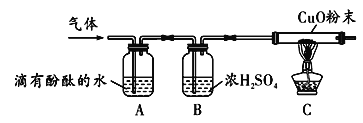
小组同学将部分皓矾晶体(ZnSO4xH2O)带回实验室,用下图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。

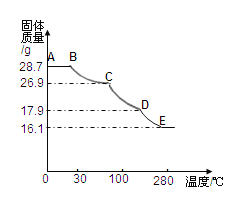
测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:(ZnSO4xH2O ==ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
⑷A中的化学方程式是____________,B中的试剂可从下列物质中选取,你的选择是_____
A.浓硫酸 B.硝酸银溶液 C.饱和碳酸钠溶液 D.澄清石灰水
⑸实验过程中若不通入CO2测得的结果将________(填“偏大”、 “偏小”或“无影响”)。根据实验结果,计算皓矾晶体中结晶水的x值为________。计算过程_____________。
⑹将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如下图,写出D-E段发生反应的化学方程式______________ 。