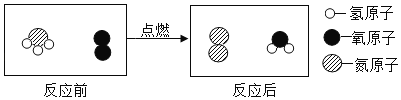
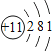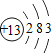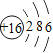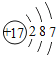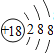题目内容
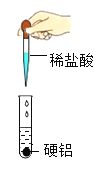
【题目】某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,实验数据如下表,请认真分析数据,回答下列问题。
甲 | 乙 | 丙 | |
烧杯+稀硫酸 | 150g | 100g | 100g |
加入的铁样品 | 6g | 6g | 10g |
充分反应后,烧杯+剩余物 | 155.8g | 105.8g | 109.8g |
(1)三位同学中_____(填甲、乙或丙)所取的稀硫酸与铁样品恰好完全反应;
(2)计算样品中铁的质量分数;_____
(3)计算恰好完全反应后所得溶液中溶质的质量分数_______。(烧杯的质量为25.48g)
【答案】(1)乙
(2)93.3%
(3)19%
【解析】
(1)甲反应前质量=150g+6g=156g,甲反应后剩余质量=155.8g,所以气体质量=156g-155.8g=0.2g,乙反应前质量=100g+6g=106g,乙反应后剩余质量=105.8g,所以气体质量=106g-105.8g=0.2g,丙反应前质量=100g+10g=110g,丙反应后质量=109.8g,所以气体质量=110g-109.8g=0.2g,所以从表中三者反应看,生成气体质量都是0.2g,而甲与乙相比,加入酸的量多,丙与乙相比,加入酸质量相等,但是铁的质量增加,但是甲和丙最终生成气体质量与乙却相等,说明甲酸过量,丙铁过量,只有乙恰好完全反应;
故答案为:乙。
(2)由(1)可知,乙完全反应,铁与硫酸反应生成硫酸亚铁和氢气,所以生成氢气质量=106g-105.8g=0.2g,设样品中铁的质量为m,
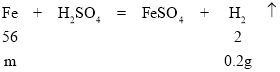
![]() ,m=5.6g,样品中铁的质量分数=
,m=5.6g,样品中铁的质量分数=![]()
故答案为:93.3%。
(3)设生成硫酸亚铁的质量为x,样品中含有5.6g铁,则剩余杂质质量=6g-5.6g=0.4g,反应后溶液质量=105.8g-烧杯质量-杂质质量=105.8g-25.48g-0.4g=79.92g,

![]() x=15.2g,
x=15.2g,
硫酸亚铁溶液中溶质的质量分数=![]()
故答案为:19%。

【题目】元素周期表是学习和研究化学的重要工具。下表是1—3周期元素的部分信息,请认真分析表中信息,回答下列问题。
| IA | 0 | ||||||
1 |
| IIA | IIIA | IVA | VA | VIA | VIIA |
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
| Z |
|
|
|
|
(1)相对原子质量为20.18的元素,其原子序数为_____,核电荷数为7的元素属于__________(填“金属元素”或“非金属元素”)。
(2)第二周期共有______种元素,该周期元素原子的质子数从左到右依次_________(填“递增” 或“递减”)。
(3)3号元素和11号元素的化学性质相似的,原因是它们的__________数相同;周期表中Z元素的原子最外层电子数为____________