题目内容
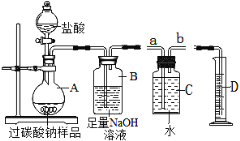
【题目】硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3 、MgO、CaO等,生产工艺流程示意如下:

[相关资料]不溶性碱受热分解后生成对应的氧化物。
(1)将菱锌矿研磨成粉的目的是 _______
(2)完成“氧化除铁”步骤中反应的化学方程式:2Fe(OH)2+Ca(ClO)2+2H2O=2____+CaCl2,这个反应中有______种元素的化合价发生了变化。
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,化学式是FeO(OH),组成元素Fe、O、H的质量比是________;
(4)根据下表数据,调节“滤液2”的pH范围为 _________;
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | - | - |
沉淀完全的pH | 12.4 | 8.0 | - | - |
开始溶解的pH | - | 10.5 | - | - |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是 _______(选填序号).
a大理石粉 b石灰乳 c纯碱溶液 d烧碱溶液
(6)“滤液4”之后的操作依次为 :蒸发浓缩、________、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于 _______.
【答案】增加反应时的接触面积,使得反应更加充分 ![]() 两
两 ![]() 8.0≤pH<10.4 bd 冷却结晶
8.0≤pH<10.4 bd 冷却结晶 ![]()
【解析】
(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分。
(2)观察方程式前后可以推出反应的化学方程式为:![]() ,铁元素由+2价变为+3价,氯元素由+1价变为-1价,其他元素化合价不变,故反应中有两种元素的化合价发生了变化。
,铁元素由+2价变为+3价,氯元素由+1价变为-1价,其他元素化合价不变,故反应中有两种元素的化合价发生了变化。
(3)![]() 组成元素Fe、O、H的质量比是:
组成元素Fe、O、H的质量比是:![]() 。
。
(4)调节滤液2的pH要想生成![]() 沉淀而不生成
沉淀而不生成![]() ,必须知道
,必须知道![]() 开始沉淀时的pH,
开始沉淀时的pH,![]() 开始沉淀时的pH,
开始沉淀时的pH,![]() 沉淀完全时的pH,
沉淀完全时的pH,![]() 沉淀完全时的pH,
沉淀完全时的pH,![]() 开始沉淀时的pH为10.4,
开始沉淀时的pH为10.4,![]() 开始沉淀时的pH为6.4,
开始沉淀时的pH为6.4,![]() 沉淀完全时的pH为12.4,
沉淀完全时的pH为12.4,![]() 沉淀完全时的pH8.0,所以理论上可选用的最大区间为8.0≤pH<10.4。
沉淀完全时的pH8.0,所以理论上可选用的最大区间为8.0≤pH<10.4。
(5)从“滤液3”制取![]() 过程中,应先转化为
过程中,应先转化为![]() ,可以使用石灰乳或烧碱溶液。
,可以使用石灰乳或烧碱溶液。
(6)“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发浓缩、冷却结晶、过滤后洗涤并干燥。
(7)设碳酸锌的质量为m,利用关系式法计算:
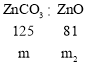
![]()
则![]() 的质量分数不低于
的质量分数不低于![]() 。
。

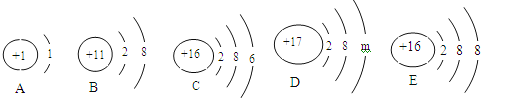
【题目】碱式碳酸镁高温能分解,可用于镁盐制备,制药工业等。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
Ⅰ.研究其分解产物
(1)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是 。
(2)检验生成物中是否含有碳酸镁、氢氧化镁。
操作现象 | 结论 | |
① | 取适量生成物置于试管中, 。 | 生成物中不含碳酸镁。 |
② | 取适量生成物置于试管中,加入热水,滴入酚酞试液, 观察到 现象。 | 生成物中不含氢氧化镁。 |
;(3)用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水是因为 。综合上述实验推断碱式碳酸镁的分解产物为二氧化碳、水和 。
Ⅱ.测定碱式碳酸镁中碳元素的质量分数
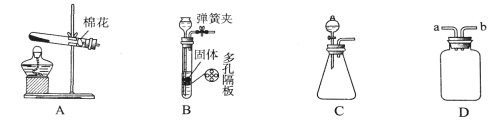
按下图一进行实验。
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为 ,若用稀盐酸代替稀硫酸,则测出碳元素的质量分数将 (填“偏大”、“偏小”或“无影响”)。
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为 ,碳元素的质量分数为 。(实验条件下CO2密度为1.97g/L)

Ⅲ.确定碱式碳酸镁的组成
设计如上图二装置,并按下述步骤操作。
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g。
步骤2:加热装置A直至样品完全反应。
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温。
步骤4:称量装置B的质量为199.2g。
(1)装置B中物质为 ,装置C的作用为 。判断样品完全反应的方法:当观察到装置B中 ,则样品已完全反应。
(2)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程。 (3分)
Ⅵ.有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗?
另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率(![]() ×100%)随温度的变化如图所示,请回答下列问题。
×100%)随温度的变化如图所示,请回答下列问题。

①0至t1℃过程中固体质量保持不变的原因是 。
②分析图像数据判定该说法是 (填“真的”或“假的”),判定理由是 。
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格。
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想Ⅰ:不相等; 猜想Ⅱ:相等;
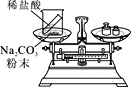
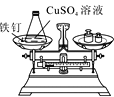
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲 组 | 乙 组 | |
实验方案 (反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转 |
结论 | 猜想Ⅰ正确 | 猜想Ⅱ正确 |
(反思评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡是有气体生成或参加的反应一定要在____中进行。
(优化装置)同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是_____(填序
号),从另外两种装置中任选一种指出其不足__________。
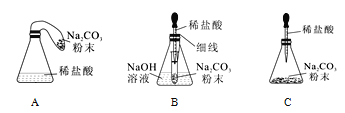
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想二正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
(解释应用)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_______种元素组成。