题目内容
【题目】向硝酸镁、硝酸银、硝酸铜的混合溶液中加入一定量的铁粉并充分反应,过滤得滤渣和滤液。
(1)加入一定量的铁粉后,一定发生的化学方程式为_____。
(2)往滤渣中加入盐酸,若无气体放出,则滤液中一定有的金属阳离子是_____。
(3)往滤渣中加入盐酸,若有气体,则滤出的滤渣是_____,反应所得溶液的质量和原溶液的质量相比_____(填“增大”、“不变”或“减小”)。
【答案】![]() Mg2+、Fe2+ Ag、Cu、Fe 减小
Mg2+、Fe2+ Ag、Cu、Fe 减小
【解析】
在金属活动性顺序里,镁、铁、铜、银四种金属的活动性顺序为镁>铁>铜>银,把一定量的铁粉加入硝酸镁、硝酸银、硝酸铜的混合溶液中,铁不能与硝酸镁溶液反应,铁首先与硝酸银溶液反应,化学方程式是![]() ,当硝酸银反应完后,铁有剩余,铁与硫酸铜溶液反应,化学方程式是
,当硝酸银反应完后,铁有剩余,铁与硫酸铜溶液反应,化学方程式是![]() ;
;
向硝酸镁、硝酸银、硝酸铜的混合溶液中加入一定量的铁粉并充分反应,过滤得滤渣和滤液,具体反应情况如下:
序号 | 反应情况 | 滤渣成分 | 滤液中溶质成分 |
1 | 铁量少,与部分硝酸银溶液反应 | Ag | Mg(NO3)2、Cu(NO3)2、AgNO3、Fe(NO3)2 |
2 | 铁量少,恰好与硝酸银溶液反应完 | Ag | Mg(NO3)2、Cu(NO3)2、Fe(NO3)2 |
3 | 铁量少,与硝酸银溶液反应完,与部分硝酸铜溶液反应 | Ag、Cu | Mg(NO3)2、Cu(NO3)2、Fe(NO3)2 |
4 | 铁量少,与硝酸银溶液反应完,恰好与硝酸铜溶液反应 | Ag、Cu | Mg(NO3)2、Fe(NO3)2 |
5 | 铁过量 | Ag、Cu、Fe | Mg(NO3)2、Fe(NO3)2 |
(1)加入一定量的铁粉后,铁粉一定与硝酸银溶液反应,生成银和硝酸亚铁,反应的化学方程式是![]() ;
;
故填:![]() 。
。
(2)往滤渣中加入盐酸,若无气体放出,也就是反应情况中的第1、2、3、4种,滤液中一定有的溶质是硝酸镁、硝酸亚铁,含有的金属阳离子是Mg2+、Fe2+;
故填:Mg2+、Fe2+。
(3)往滤渣中加入盐酸,若有气体生成,也就是反应情况中的第5中,滤出的滤渣是Ag、Cu、Fe;反应所得溶液的质量和原溶液的质量如下:
①Fe与硝酸银溶液反应:![]() ,反应后溶液的质量减小;
,反应后溶液的质量减小;
②Fe与硝酸铜溶液反应:![]() ,反应后溶液的质量减小;
,反应后溶液的质量减小;
所以反应后所得溶液的质量和原溶液的质量相比,溶液的质量减小。
故填: Ag、Cu、Fe 减小。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】运用溶解度表与溶解度曲线回答下列问题:
温度/°C | 10 | 30 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
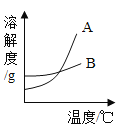
(1)B是 _____________(填“氯化钠”或“硝酸钾”)的溶解度曲线。
(2)60℃时,向100g水中加入100g硝酸钾,所得溶液的溶质质量分数为_____________,当该溶液从60℃降温到30℃时,析出晶体的质量为_____________g。
(3)现有50℃A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是_____(填序号)。
①降低温度 ②升高温度 ③加入A物质
【题目】同学们探究氢氧化钠与盐酸能否发生化学反应。
[探究活动1]同学进行了如图实验:
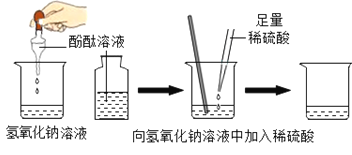
加入一定量稀盐酸后观察到溶液由红色变为无色,证明二者发生了反应。上述实验操作中有一处明显错误,请加以改正_______________。要证明稀盐酸与氢氧化钠发生了反应,除了上述方法之外,还可以按照下表实验获得结论。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量稀盐酸后,再加入少量氧化铜 | ________________ | 氢氧化钠和盐酸发生了反应。加入氧化铜后发生反应的化学方程式为_____________ |
[探究活动2]如果在[探究活动1 ]中直接倾倒稀盐酸至溶液由红色变为无色,最终烧杯内的溶液中溶质的成分是什么? ( 指示剂除外)
[猜想与假设]甲猜想:氯化钠
乙猜想:_______________
甲为了证明自己的猜想,进行如下实验:
实验操作 | 实验现象 | 实验结论 |
取反应后的溶液于烧杯中,加入铁粉 | _____________ | 猜想错误 |
[探究活动3 ]中和反应能否通过判断有水生成来证明其反应发生?
[设计实验]乙取变色硅胶、无水醋酸和氢氧化钠固体进行如图2的三个对比实验。
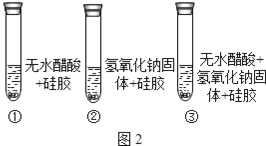
[查阅资料] a.变色硅胶吸水后由蓝色变为红色;
b.无水醋酸是一种酸,常温下为无色液体;
(1)加入试剂后.要迅速塞紧橡胶塞的原因是___________。
(2)能证明酸和碱反应有水生成的现象是___________。