题目内容
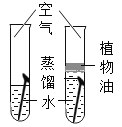
【题目】镁、铝是比较活泼的金属。镁在空气中燃烧时,不仅生成氧化镁、氮化镁,还有少量镁与二氧化碳反应生成另一种单质和镁的氧化物。但是铝却具有很好的抗腐蚀性能。
(1)镁在空气中燃烧的现象为:发出耀眼的白光,_____。
(2)请用化学方程式表示铝具有很好的抗腐蚀性能的原因:_____。
(3)请写出镁与二氧化碳反应的化学方程式:_____。
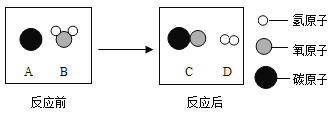
【答案】生成白色固体,放出大量的热 ![]()
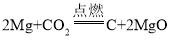
【解析】
(1)镁在空气中燃烧的现象是发出耀眼的白光,生成白色固体,放出大量的热。
(2)铝具有很好的抗腐蚀性能是因为铝与空气中的氧气反应生成致密的氧化铝薄膜,保护好铝制品,反应方程式为![]() 。
。
(3)镁与二氧化碳反应生成另一种单质和镁的氧化物,根据质量守恒定律分析,生成的单质不可能是氧气,因为氧气会与镁反应,则生成的单质是碳,还剩余镁元素和氧元素,所以生成的氧化物是氧化镁。反应方程式为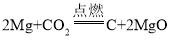 。
。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】运用溶解度表与溶解度曲线回答下列问题:
温度/°C | 10 | 30 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
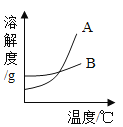
(1)B是 _____________(填“氯化钠”或“硝酸钾”)的溶解度曲线。
(2)60℃时,向100g水中加入100g硝酸钾,所得溶液的溶质质量分数为_____________,当该溶液从60℃降温到30℃时,析出晶体的质量为_____________g。
(3)现有50℃A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是_____(填序号)。
①降低温度 ②升高温度 ③加入A物质
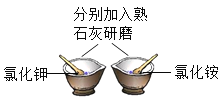
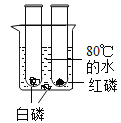
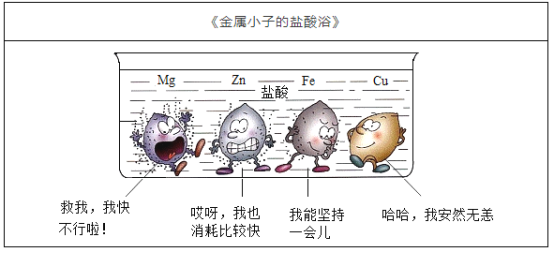
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。
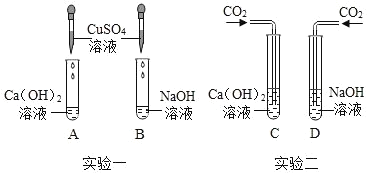
(1)实验一中,A、B 两支试管中共同的实验现象是__________________,其中B试管内发生反应的化学方程式为__________________。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是___________(填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
[提出猜想]猜想1:溶质是NaOH;猜想2:溶质是NaOH和Na2CO3;猜想3:溶质是Na2CO3。
[实验验证]
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中,加入过量稀盐酸 | _______________ | 猜想1不成立 |
②取D中少量溶液于试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
[反思与评价]
(1)小军评价实验操作②中加入Ca( OH)2溶液不正确,理由是__________________。
(2)实验室中氢氧化钠要密封保存的原因是____________________。