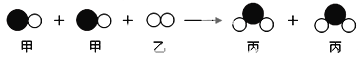题目内容
【题目】同学们在学习过程中了解到,CO、H2、C都是具有还原性的物质,在一定条件下能还原氧化铁或氧化铜等物质,在老师的指导下,全班同学分成了三个实验小组进行实验。
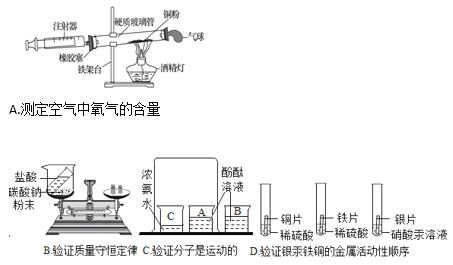
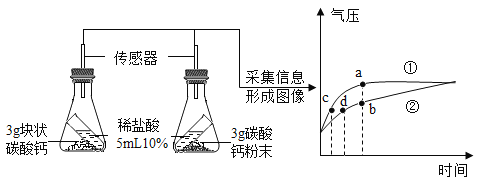
(一)甲组同学对炼铁产生了兴趣,他们所用的药品和装置如图所示 (杂质不参与任何反应)。请回答有关问题:
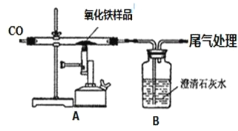
(1)组装好实验装置后,应先进行的操作是_______,再装入药品。实验开始时,先通一会 CO,作用是_____。
(2)实验进行一段时间后,玻璃管A中出现的主要现象为________,A 装置中反应的方程式为_____________。
(3)停止加热后,还要再通一会儿CO,除了将A装置中的CO2送入 B 装置的溶液中,另一个作用是______。
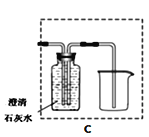
(4)若将B装置改成C虚线方框内装置,则该装置还起到的作用是________。
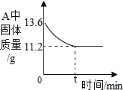
(5)若反应过程中装置A固体质量的变化情况如图所示,则所取氧化铁样品中Fe2O3的质量为__________g。
(二)乙组同学设计了下图所示的装置,测定水的组成 (杂质不参加反应,已知浓硫酸具有吸水性,假定A、C装置能完全吸收相应的物质)。
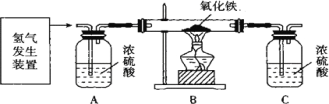
反应后测得B中玻璃管 (含药品)质量减少ag,C中洗气瓶 (含药品)质量增加 bg。请回答有关问题:
(1)请用含 a、b的式子表示出水中氢、氧元素的质量比为__________
(2)下列因素中,对测定结果无影响的是_______ (填序号)。
A.玻璃管中的氧化铁没有完全反应 B.缺少A 装置
C.氧化铁不干燥 D.有部分氧化铁被还原成了四氧化三铁
(三)丙组同学利用如图所示的装置进行了木炭还原氧化铜的实验探究,并利用铁丝网罩集中火力,以获得反应所需的高温。
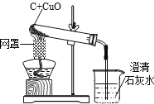
(提出问题)
木炭还原氧化铜产生什么气体?
(提出猜想)
根据反应前后元素组成不变,产生的气体有三种情况:
①CO;②CO2;③____________
(设计方案)实验前后分别对试管和烧杯里的物质进行称量,数据设计如下:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | M1 | M2 | △m1 即(M1-M2) |
烧杯+澄清石灰水 | M3 | M4 | △m2 即(M4-M3) |
(1)若△m2=0,说明反应产生的气体不能被澄清石灰水吸收,则猜想_____________成立。
(2)若猜想②正确,理论上△m1与△m2的关系是:△m1___________△m2(填“>”、“<”或“=”)。
(实验并记录)实验得到的数据如下表:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | 69.8g | 65.4g | △m1 |
烧杯+澄清石灰水 | 118.8g | 122.6g | △m2 |
用以上实验数据分析,结果应该是猜想_______成立。根据这个结论,该实验装置的缺陷是__________。
(反思与评价)经查阅资料知道:木炭还原氧化铜产生CO2气体,该反应的化学方程式为:_______。
本次实验结果与资料显示不一致,你觉得可能原因是_________ (填序号)。
A.装置漏气 B.生成的CO2 部分与过量的C反应生成了CO
C.装置内还残留有CO2气体未被吸收
【答案】检查装置气密性 排净空气防爆炸 红色固体变黑 3CO+Fe2O3![]() 2Fe+3CO2 防倒吸/防氧化 收集CO防污染 8
2Fe+3CO2 防倒吸/防氧化 收集CO防污染 8 ![]() AD CO和CO2 ① = ③ 尾气未处理 2CuO+C
AD CO和CO2 ① = ③ 尾气未处理 2CuO+C![]() 2Cu+CO2↑ ABC
2Cu+CO2↑ ABC
【解析】
(一)(1)组装好实验装置后,应先进行的操作是检查装置气密性,再装入药品。实验开始时,先通一会 CO,作用是排净空气防爆炸。
(2)实验进行一段时间后,玻璃管A中的氧化铁被CO还原为Fe单质,因此会看到玻璃管A中的固体物质由红棕色变为黑色,在A装置中反应的方程式为3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。
(3)停止加热后,还要再通一会儿CO,除了将A装置中的CO2送入B装置的溶液中,另一个作用是防止Fe在热的空气中再被氧化为Fe2O3;同时由于装置气体温度降低,压强减小,澄清石灰水可能会被倒吸至A,使容器炸裂,即通入CO的作用是防止氧化和防倒吸。
(4)CO有毒,应进行尾气处理,若将B装置改成C 虚线方框内装置,则该装置还起到的作用是收集CO,防止污染大气的作用。
(5)若反应过程中装置A固体质量的变化情况如图所示,固体减少的质量即氧化铁中氧元素的质量:13.6g-11.2g=2.4g,设氧化铁的质量为x,则![]() ,x=8g,则所取氧化铁样品中Fe2O3的质量为8g。
,x=8g,则所取氧化铁样品中Fe2O3的质量为8g。
(二)(1)反应后测得B中玻璃管 (含药品)质量减少ag是氧元素的质量,C中洗气瓶 (含药品)质量增加 bg包含氧元素和氢元素,故水中氢、氧元素的质量比为![]() 。
。
(2)A、玻璃管中的氧化铁没有完全反应,不会影响氢、氧元素的比例关系,故A正确; B、缺少A 装置,则会造成水的质量偏大,而计算的氧元素取决于固体减少的质量,会造成氢、氧质量比偏大,故B错误;
C、氧化铁不干燥,加热过程中导致测得减少的固体质量比氧化铁中氧元素的质量偏大,而且测得水的质量也不准确,故C错误;
D、有部分氧化铁被还原成了四氧化三铁,不会影响氢、氧元素的比例关系,故D正确。故选AD。
(三)[提出猜想]木炭还原氧化铜产生什么气体应可能有:①CO;②CO2;③CO和CO2三种情况;
[设计方案](1)因CO不溶于水,CO2溶于澄清石灰水中。△m2=0,说明反应产生的气体不能被澄清石灰水吸收,该气体是CO,所以猜想①成立;
(2)因CO不溶于水,CO2溶于溶于澄清石灰水中,若猜想②正确,理论上△m1与△m2相等,即:△m1=△m2;
[实验并记录]根据实验数据得到,△m1 = M1-M2=69.8g-65.4g=4.4g;△m2=M4 -M3 =122.6g-118.9g=3.7g,△m2≠0且△m1 ≠△m2 ,因此猜想①②均不正确,猜想③成立。
[反思与评价]经查阅资料知道:木炭还原氧化铜产生CO2气体,该反应的化学方程式为:CuO+C![]() 2Cu+CO2↑。
2Cu+CO2↑。
本次实验结果与资料显示不一致,你觉得可能原因是
A、若装置漏气,对△m1没有影响,但生成的CO2 部分漏出,造成△m2偏低,故A正确;
B、若生成的CO2部分与过量的C反应生成了CO,会造成CO2偏低,△m2偏低,故B正确;
C、若装置内还有CO2气体未被吸收,会造成△m2偏低,故C正确。因此合理选项是ABC。

【题目】物质丙是重要的化工产品,在国民经济中占有重要地位。工业上用甲和乙合成丙。甲、乙、丙的微观示意图见下表。请完成下列空白。
物质 | 甲 | 乙 | 丙 |
|
微观示意图 |
|
|
|
(1)甲、乙、丙3种物质都是由 (填“分子”“原子”或“离子”)_____构成的。
(2)甲、乙、丙中属于化合物的是_____。
(3)物质丙中氮元素的化合价为_____。
(4)丙中氮、氢元素的质量比为_____。
(5)写出甲和乙在高温、高压、催化剂的条件下合成丙的化学方程式:_____。