题目内容
【题目】以下为某实验小组进行的几组实验,根据要求回答问题。
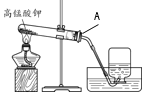
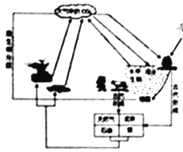
(1)根据图中两组实验回答问题。
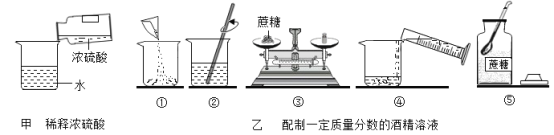
①指出甲实验中不正确的操作______。
②乙实验中,正确的操作顺序为(填序号):⑤→______→②:若用量简量取水时仰视读数,会导致所配溶液的溶质质量分数______(填“偏大”或“偏小”)。
(2)如图所示四个验证实验,不能达到实验目的是______。
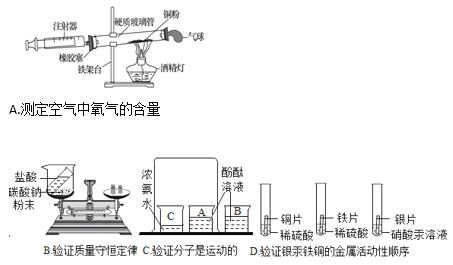
【答案】没有用玻璃棒搅拌 ③①④ 偏小 BD
【解析】
(1)①稀释浓硫酸时,应用玻璃棒不断搅拌,以散失热量,故填没有用玻璃棒搅拌;
②配制一定溶质质量分数的溶液的基本步骤:计算、称量、量取、溶解、装瓶贴签,可知配制溶液的正确操作顺序⑤③④①②,故填. ③①④;
若用量简量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故填偏小。
(2)A、铜和氧气在加热的条件下生成氧化铜,可以验证空气中氧气的含量,选项正确;
B、碳酸钠和盐酸反应生成氯化钠水和二氧化碳,生成的二氧化碳会逸散到空气中,该反应需要在密闭容器中反应,选项错误;
C、酚酞遇碱变红色,A烧杯中的酚酞变红色,可以验证分子运动,选项正确;
D、铜不会与稀硫酸反应,铁会与稀硫酸反应,银不会与硝酸汞反应,不可以验证三种金属的活动性顺序为:铁、铜、汞,选项错误,故选BD。

 阅读快车系列答案
阅读快车系列答案【题目】请从A或B两题中任选1个作答,若两题均作答,按 A计分。
A用下图装置制取氧气 | B用下图装置制取二氧化碳 |
| |
(1)仪器a的名称是_______。 (2)制氧气的化学方程式为________。 (3)能用排水法收集氧气的原因是_______。 | (1)仪器b的名称是_______。 (2)制二氧化碳的化学方程式为_______。 (3)能用向上排空气法收集二氧化碳的原因是_______。 |
【题目】同学们在学习过程中了解到,CO、H2、C都是具有还原性的物质,在一定条件下能还原氧化铁或氧化铜等物质,在老师的指导下,全班同学分成了三个实验小组进行实验。
(一)甲组同学对炼铁产生了兴趣,他们所用的药品和装置如图所示 (杂质不参与任何反应)。请回答有关问题:
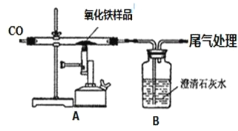
(1)组装好实验装置后,应先进行的操作是_______,再装入药品。实验开始时,先通一会 CO,作用是_____。
(2)实验进行一段时间后,玻璃管A中出现的主要现象为________,A 装置中反应的方程式为_____________。
(3)停止加热后,还要再通一会儿CO,除了将A装置中的CO2送入 B 装置的溶液中,另一个作用是______。
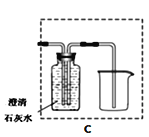
(4)若将B装置改成C虚线方框内装置,则该装置还起到的作用是________。
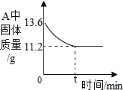
(5)若反应过程中装置A固体质量的变化情况如图所示,则所取氧化铁样品中Fe2O3的质量为__________g。
(二)乙组同学设计了下图所示的装置,测定水的组成 (杂质不参加反应,已知浓硫酸具有吸水性,假定A、C装置能完全吸收相应的物质)。
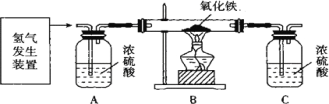
反应后测得B中玻璃管 (含药品)质量减少ag,C中洗气瓶 (含药品)质量增加 bg。请回答有关问题:
(1)请用含 a、b的式子表示出水中氢、氧元素的质量比为__________
(2)下列因素中,对测定结果无影响的是_______ (填序号)。
A.玻璃管中的氧化铁没有完全反应 B.缺少A 装置
C.氧化铁不干燥 D.有部分氧化铁被还原成了四氧化三铁
(三)丙组同学利用如图所示的装置进行了木炭还原氧化铜的实验探究,并利用铁丝网罩集中火力,以获得反应所需的高温。
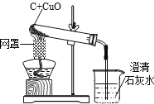
(提出问题)
木炭还原氧化铜产生什么气体?
(提出猜想)
根据反应前后元素组成不变,产生的气体有三种情况:
①CO;②CO2;③____________
(设计方案)实验前后分别对试管和烧杯里的物质进行称量,数据设计如下:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | M1 | M2 | △m1 即(M1-M2) |
烧杯+澄清石灰水 | M3 | M4 | △m2 即(M4-M3) |
(1)若△m2=0,说明反应产生的气体不能被澄清石灰水吸收,则猜想_____________成立。
(2)若猜想②正确,理论上△m1与△m2的关系是:△m1___________△m2(填“>”、“<”或“=”)。
(实验并记录)实验得到的数据如下表:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | 69.8g | 65.4g | △m1 |
烧杯+澄清石灰水 | 118.8g | 122.6g | △m2 |
用以上实验数据分析,结果应该是猜想_______成立。根据这个结论,该实验装置的缺陷是__________。
(反思与评价)经查阅资料知道:木炭还原氧化铜产生CO2气体,该反应的化学方程式为:_______。
本次实验结果与资料显示不一致,你觉得可能原因是_________ (填序号)。
A.装置漏气 B.生成的CO2 部分与过量的C反应生成了CO
C.装置内还残留有CO2气体未被吸收
【题目】为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式:______。
老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气;猜想二:二氧化硫;猜想三:氢气和二氧化硫的混合物。
(查阅资料)二氧化硫可以使品红溶液褪色,也能被氢氧化钾溶液吸收。浓硫酸只吸收水。
(实验探究)师生设计了如下装置进行实验![]() 部分仪器省略
部分仪器省略![]() ,请完成下列表格。
,请完成下列表格。
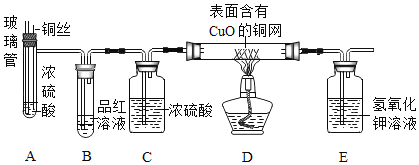
主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的现象是 ______ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显现象 | 猜想 ______ 正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | | |
④冷却,将A中液体用水稀释 | A中液体变为 ______ 色 | 有硫酸铜生成 |
(表达交流)(1)在步骤③中,鼓入空气的目的是______。
(反思拓展)(2)若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是______,C装置的作用是:______。
(3)下列各组药品能够证明锌的活动性比铜强的是______![]() 填序号
填序号![]() 。
。
①锌、铜、稀盐酸
②锌、硫酸铜溶液
③锌、铜、氯化镁溶液
(1)加热A装置一段时间后,气泡产生的速率由快变慢最后不再产生,请对这一现象进行解释:______。
(2)请尝试写出铜与浓硫酸反应的化学方程式:______。