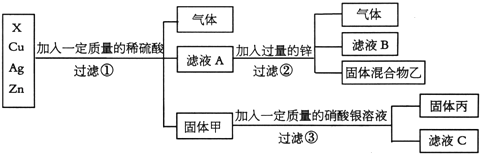
题目内容
【题目】化学源于生活,生中蕴含着许多化学知识。请根据所学化学知识填空:
(1)①青少年处于生长发育期,为预防患佝偻病,可以多吃奶制品、虾皮等食物,补充人体需要的_____元素。
②生活中将硬水转化为软水常用的方法是__________。
③炒菜时油锅中的油不慎着火,可用锅盖盖灭,其灭火原理为_____________。
(2)在建沪通大桥是长江上最长的公铁两用大桥。大桥建设及通行涉及到许多化学知识。
①制造大桥护栏和斜拉索等重要器件的材料都是钢,钢属于_____(选填“金属”或“合成”)材料。
②工人给大桥钢铁器件喷上油漆,目的是为了防止铁与_____发生反应而生锈。
③大桥施工过程中用乙快(C2H2)燃烧的火焰来焊接金属,乙炔在空气中完全燃烧生成二氧化碳和水,该反应的化学方程式为_____________________________。
④大桥的建成,缩短了南通到上海的时间,有利于节约化石燃料的使用,下列环境问题与化石燃料使用无关的是______(填序号)。
A.雾霾天气 B.温室效应 C.赤潮的形成 D.酸雨的形成
【答案】 钙(Ca) 煮沸 隔绝空气 金属 氧气和水(或O2和H2O) 2C2H2+5O2![]() 4CO2+2H2O C
4CO2+2H2O C
【解析】(1)①缺乏钙元素时易导致佝偻病,牛奶、虾皮等食物,含有较多的钙元素,多吃奶制品、虾皮等食物,补充人体需要的钙元素;②硬水是含可溶钙镁化合物较多的水,煮沸可以将硬水中的钙镁化合物转化成沉淀而降低水的硬度。生活中将硬水转化为软水常用的方法是煮沸;③燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;灭火时只需要破坏一个条件即可。炒菜时油锅中的油不慎着火,可用锅盖盖灭,其灭火原理为隔绝空气;(2) ①金属和合金都属于金属材料; ②铁生锈是铁与氧气、水共同作用的结果,所以防锈的方法有隔绝氧气、保持金属表面洁净干燥、改变金属的组成和结构;工人给大桥钢铁器件喷上油漆,目的是为了防止铁与氧气、水发生反应而生锈;③乙炔和氧气点燃条件下生成二氧化碳和水,该反应的化学方程式为2C2H2+5O2![]() 4CO2+2H2O;④化石燃料的使用会产生大量有害气体和烟尘及二氧化碳,会导致雾霾天气 、温室效应,燃烧产生二氧化硫导致酸雨的形成,赤潮,又称红潮,是在特定的环境条件下,海水中某些浮游植物、原生动物或细菌爆发性增殖或高度聚集而引起水体变色的一种有害生态现象。赤潮现象与化石燃料的使用无关。
4CO2+2H2O;④化石燃料的使用会产生大量有害气体和烟尘及二氧化碳,会导致雾霾天气 、温室效应,燃烧产生二氧化硫导致酸雨的形成,赤潮,又称红潮,是在特定的环境条件下,海水中某些浮游植物、原生动物或细菌爆发性增殖或高度聚集而引起水体变色的一种有害生态现象。赤潮现象与化石燃料的使用无关。

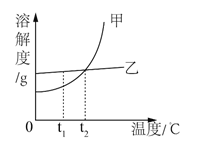
【题目】下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g 水)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
①20℃时溶解度较大的物质是_________ ;
②除去KNO3晶体中混有的少量 NaCl,通过溶解、蒸发浓缩、______、过滤、洗涤、干燥得到比较纯净的KNO3晶体。滤液中溶质的成分有___________。
③用 4 只小烧杯取 T℃时的水各 50 克,进行实验并记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
KNO3 质量/g | 40 | 50 | 60 | 70 |
H2O质量/g | 50 | 50 | 50 | 50 |
溶液质量/g | 90 | 100 | 105 | X |
Ⅰ.实验 1 所得溶液的质量分数为_______ ,实验 4 中 X 的值为 _________,
Ⅱ. T℃时KNO3 的溶解度是 _________ g/100g 水。
【题目】梅老师带领的化学兴趣小组在学习资料卡片“石笋和钟乳石的形成”时,发现难溶于水的CaCO3当遇到溶有CO2的水时,会发生反应:CaCO3+CO2+H2O= Ca(HCO3)2,反应生成的Ca(HCO3)2溶解性较大。联想到实验室检验CO2时,将气体通入澄清石灰水中能生成CaCO3。若长时间往澄清石灰水中通入CO2会产生什么样的现象呢?如果长时间向碱溶液中通入二氧化碳又会如何反应?小章和小丽决定用小烧杯盛装一定量的氢氧化钠溶液并不断通入二氧化碳气体进行探究。
【提出问题】
氢氧化钠溶液中通入二氧化碳一段时间后,溶液中会有什么溶质?
【查阅资料】
(1)通入少量的二氧化碳时,NaOH与CO2能反应的化学方程式_____________。
(2)通入过量的二氧化碳时,反应的化学方程式为Na2CO3+CO2+H2O= 2NaHCO3
(3)碳酸氢盐都能溶于水
(4)Na2CO3、NaHCO3的溶液呈碱性、BaCl2呈中性
【提出猜想】
(1)溶质有NaOH、Na2CO3; (2)溶质为Na2CO3;
(3)溶质是___________________(填化学式); (4)溶质全部是NaHCO3
【设计实验方案】
实验步骤 | 实验现象 | 实验结论 |
①用试管取少量小烧杯中反应后的溶液,滴加几滴________试液(填酸碱指示剂) | 溶液变红色 | 该溶液显碱性 |
②将小烧杯中反应后剩下的溶液进行称量,然后滴加过量的BaCl2溶液 | 有_________生成 | 猜想(4)不成立 |
③取步骤②静置后的上层清液, 滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2)不成立 |
【得出结论】猜想(3)成立
【讨论交流】
(1)小王同学提出实验步骤①是多余的。你认为该实验设计_______________(填“需要”或“不需要”),理由______________________。
(2)将实验步骤②剩下混合物进行过滤、洗涤、干燥、称量。发现所得沉淀质量等于步骤②中所称量的溶液质量的十分之一,试计算氢氧化钠溶液中通入二氧化碳一段时间后,溶液中Na2CO3的质量分数为__________________。(写出计算过程,最后结果保留小数点后两位)
(3)验证二氧化碳性质时,如果长时间向澄清石灰水中通入二氧化碳会看到什么样的现象呢?请你描述一下:_____________________。
【知识拓展】
梅老师引导同学们再次研读教材,发现遇热或压强变小时,Ca(HCO3)2又能反应生成CaCO3,并告诉同学们,干粉灭火器中用NaHCO3灭火的原理与之类似,请写出该反应方程式_______,在生活中,NaHCO3还有许多用处,请说出一种____________。
【题目】某兴趣小组在准备化学实验基本技能考查时,对以下问题进行了探究.。
Ⅰ.探究酸和碱能否发生反应
方案 | 方案1 | 方案2 |
实验操作 及现象 | 甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液。由_______色变成无色。 | 乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了。 |
实验结论 | 酸和碱能发生反应 | 酸和碱能发生反应 |
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液;大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须___(填“小于”或“小于或等于”)7才能证明酸和碱能发生反应。请写出稀硫酸和氢氧化钠溶液反应的化学方程式_______
Ⅱ.探究酸和碱反应后溶液中溶质的成分
丙同学对Ⅰ中甲同学实验后的无色溶液展开探究。
【提出问题】试管中无色溶液的溶质除了酚酞还有什么?
【提出猜想】(l)Na2SO4 (2)Na2SO4和_____
【设计实验】
实验操作 | 实验现象 | 实验结论 | |
方案1 | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液。 | 锌粒逐渐减少,有____产生 | 猜想(2)成立 |
方案2 | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管。 | 开始无明显现象,过一会发现__________ |
【实验反思与拓展】
为了验证猜想(2)成立,你认为还可以选择的药品是_______(填字母序号)
A.BaCl2溶液 B.Cu C.CuO