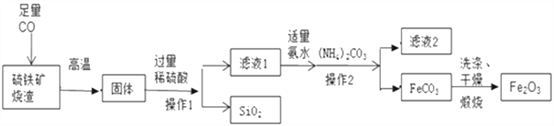
题目内容
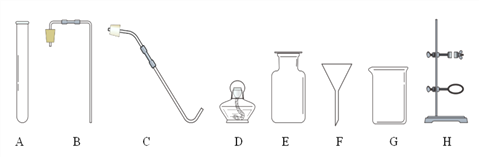
【题目】已知某混合气体由H2、CO和CO2三种气体组成,为验证该混合气体成分,设计了如图所示的实验方案:
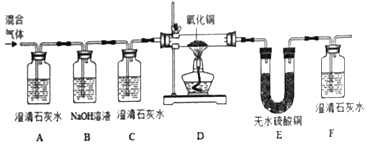
根据方案回答下列问题:
①装置C在实验中的作用是____________;仅根据D装置中黑色粉末变红这一现象,不能证明混合气体中一定存在CO,理由是___________(用化学方程式表示);
②E中出现白色硫酸铜粉末变成蓝色,发生反应的化学方程式是_________________;
③该装置不能检验出的气体是____________,如需检验,改进的意见是____________;
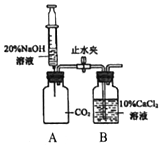
④上图方案B装置可用来吸收CO2,但没有现象,为证明CO2和NaOH能发生反应,设计如图装置进行实验,向充满CO2的试剂瓶中注入过量20%的NaOH溶液,振荡后打开止水夹,观察到的现象是_______,反应后将AB试剂瓶中混合物过滤,所得溶液中除CaCl2外,还有的溶质是________,整个实验过程中发生的化学方程式是__________。
【答案】 检验CO2是否吸收完全,防止其干扰CO的检验; ![]() ; CuSO4+5H2O==CuSO45H2O; H2; 在C、D间增加干燥装置; B中溶液倒吸入A中,A中出现白色沉淀; NaCl、NaOH; CO2+2NaOH==Na2CO3+H2O;Na2CO3+CaCl2==CaCO3↓+2NaCl
; CuSO4+5H2O==CuSO45H2O; H2; 在C、D间增加干燥装置; B中溶液倒吸入A中,A中出现白色沉淀; NaCl、NaOH; CO2+2NaOH==Na2CO3+H2O;Na2CO3+CaCl2==CaCO3↓+2NaCl
【解析】①装置C的作用是检验CO2是否吸收完全,防止其干扰CO的检验。氢气也具有还原性,能把化铜还原为铜。②白色硫酸铜粉末能与水发生化合反应生成蓝色硫酸铜晶体。③从装置C出来的气体中含有水蒸气,不能确定氢气是否存在,如果在C、D间增加干燥装置,可确定氢气是否存在。 ④氢氧化钠溶液与二氧化碳反应,A瓶内气体减少,压强变小,打开止水夹,B中溶液倒吸入A中。2NaOH + CO2=== Na2CO3 + H2O,Na2CO3 + CaCl2 == CaCO3↓+ 2NaCl,因为实验时,注入过量20%的NaOH溶液,所以反应后将AB试剂瓶中混合物过滤,所得溶液中除CaCl2外,还有的溶质有生成的NaCl、剩余的NaOH;A中会出现白色沉淀。