��Ŀ����
����Ŀ��÷��ʦ����Ļ�ѧ��ȤС����ѧϰ���Ͽ�Ƭ��ʯ�������ʯ���γ���ʱ������������ˮ��CaCO3����������CO2��ˮʱ���ᷢ����Ӧ��CaCO3+CO2+H2O= Ca(HCO3)2����Ӧ���ɵ�Ca(HCO3)2�ܽ��Խϴ����뵽ʵ���Ҽ���CO2ʱ��������ͨ�����ʯ��ˮ��������CaCO3������ʱ��������ʯ��ˮ��ͨ��CO2�����ʲô���������أ������ʱ�������Һ��ͨ�������̼�ֻ���η�Ӧ��С�º�С��������С�ձ�ʢװһ����������������Һ������ͨ�������̼�������̽����
��������⡿
����������Һ��ͨ�������̼һ��ʱ�������Һ�л���ʲô���ʣ�
���������ϡ�
(1)ͨ�������Ķ�����̼ʱ��NaOH��CO2�ܷ�Ӧ�Ļ�ѧ����ʽ_____________��
(2)ͨ������Ķ�����̼ʱ����Ӧ�Ļ�ѧ����ʽΪNa2CO3+CO2+H2O= 2NaHCO3
(3)̼�����ζ�������ˮ
(4)Na2CO3��NaHCO3����Һ�ʼ��ԡ�BaCl2������
��������롿
(1)������NaOH��Na2CO3�� (2)����ΪNa2CO3��
(3)������___________________(�ѧʽ)�� (4)����ȫ����NaHCO3
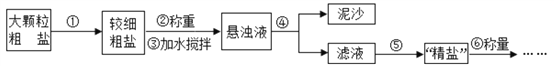
�����ʵ�鷽����
ʵ�鲽�� | ʵ������ | ʵ����� |
�����Թ�ȡ����С�ձ��з�Ӧ�����Һ���μӼ���________��Һ(�����ָʾ��) | ��Һ���ɫ | ����Һ�Լ��� |
�ڽ�С�ձ��з�Ӧ��ʣ�µ���Һ���г�����Ȼ��μӹ�����BaCl2��Һ | ��_________���� | ����(4)������ |
��ȡ����ھ��ú���ϲ���Һ�� ����ϡ���� | ������ð�� | ����(1)��(2)������ |
���ó����ۡ�����(3)����
�����۽�����
(1)С��ͬѧ���ʵ�鲽����Ƕ���ġ�����Ϊ��ʵ�����_______________(������Ҫ����������Ҫ��)������______________________��
(2)��ʵ�鲽���ʣ�»������й��ˡ�ϴ�ӡ�����������������ó����������ڲ����������������Һ������ʮ��֮һ���Լ�������������Һ��ͨ�������̼һ��ʱ�������Һ��Na2CO3����������Ϊ__________________��(д��������̣����������С�������λ)
(3)��֤������̼����ʱ�������ʱ�������ʯ��ˮ��ͨ�������̼�ῴ��ʲô���������أ���������һ�£�_____________________��
��֪ʶ��չ��
÷��ʦ����ͬѧ���ٴ��ж��̲ģ��������Ȼ�ѹǿ��Сʱ��Ca(HCO3)2���ܷ�Ӧ����CaCO3��������ͬѧ�ǣ��ɷ����������NaHCO3����ԭ����֮���ƣ���д���÷�Ӧ����ʽ_______���������У�NaHCO3���������ô�����˵��һ��____________��
���𰸡� 2NaOH��CO2��Na2CO3��H2O Na2CO3��NaHCO3 ��̪ ��ɫ���� ����Ҫ NaOH��Na2CO3��NaHCO3���ʼ��� 5.38% �տ�ʼ��������������ͨ�������̼����������ʧ 2NaHCO3![]() Na2CO3��CO2��+H2O ���ͷ� �� ����θ������
Na2CO3��CO2��+H2O ���ͷ� �� ����θ������
��������̽����ʢװһ����������������Һ���ձ��в���ͨ�������̼�������Һ�ijɷ֡���������⡿����������Һ��ͨ�������̼һ��ʱ�����Һ�л���ʲô���ʣ����������ϡ�(1)ͨ�������Ķ�����̼ʱ��NaOH��CO2�ܷ�Ӧ�Ļ�ѧ����ʽ��2NaOH��CO2��Na2CO3��H2O��(2)ͨ������Ķ�����̼ʱ����Ӧ�Ļ�ѧ����ʽΪNa2CO3+CO2+H2O= 2NaHCO3��(3)̼�����ζ�������ˮ(4)Na2CO3��NaHCO3����Һ�ʼ��ԡ�BaCl2�����ԡ���������롿(1)������NaOH��Na2CO3��(2)����ΪNa2CO3��(3)������Na2CO3��NaHCO3�� (4)����ȫ����NaHCO3�������ʵ�鷽����
ʵ�鲽�� | ʵ������ | ʵ����� |
�����Թ�ȡ����С�ձ��з�Ӧ�����Һ���μӼ��η�̪ ��Һ(�����ָʾ��) | ��Һ���ɫ����̪��Һ�����졣 | ����Һ�Լ��� |
�ڽ�С�ձ��з�Ӧ��ʣ�µ���Һ���г�����Ȼ��μӹ�����BaCl2��Һ | �а�ɫ�������ɣ�̼������Һ��BaCl2��Һ��Ӧ����̼�ᱵ��ɫ�������Ȼ��ơ� | ����(4)������ |
��ȡ����ھ��ú���ϲ���Һ�� ����ϡ���� | ������ð����̼���������ᷴӦ���ɶ�����̼�� | ����(1)��(2)������ |
���ó����ۡ�����(3)�����������۽�����(1)ʵ�鲽����Ƕ���ġ���ʵ����Ʋ���Ҫ��������NaOH��Na2CO3��NaHCO3 ��Һ���ʼ��ԡ�(2)��ʵ�鲽���ʣ�»������й��ˡ�ϴ�ӡ�����������������ó����������ڲ����������������Һ������ʮ��֮һ������������Һ��ͨ�������̼һ��ʱ�����Һ��Na2CO3����������Ϊ��
��������Һ��̼��������Ϊy,ʵ�鲽���ʣ�»������й������ó�������Ϊxg,�����������������Һ����Ϊ10xg
Na2CO3��BaCl2��BaCO3����2NaCl
106 197
yg x
![]() ��
��![]() ,y��0.538x��
,y��0.538x��
��Һ��Na2CO3����������Ϊ��![]() ��100����53.8����
��100����53.8����
(3)��֤������̼����ʱ�������ʱ�������ʯ��ˮ��ͨ�������̼�ῴ���տ�ʼ��������������ͨ�������̼����������ʧ��CO2+Ca(OH)2=CaCO3��+H2O��CaCO3+CO2+H2O= Ca(HCO3)2![]() Na2CO3��CO2��+H2O�������У�NaHCO3���������ô���NaHCO��Һ�������ԣ����ᷴӦ���ɶ�����̼�����ͷۡ�����θ�����ȡ�
Na2CO3��CO2��+H2O�������У�NaHCO3���������ô���NaHCO��Һ�������ԣ����ᷴӦ���ɶ�����̼�����ͷۡ�����θ�����ȡ�

 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�����Ŀ����������315�ع�������α����Ʒ���ḻ�Ļ�ѧ֪ʶ�ܰ���ʶ��α����Ʒ�������Ƕ�һ������Ԫ�����Ĵ�ٻ�� �������ϣ���֪������Ԫ�������Ǵ��𣬼�����Ԫ������ͭп�Ͻ�
(1)Ϊ�˼��������Ԫ��������٣���������·���
A �û����� B. �μ�����п��Һ
���Ϸ������е���(�����)_________�������������е�������_______________��
(2)��÷ͬѧȡһ������������Ԫ�����������ձ��гƵ�����Ԫ����������Ϊ50 g Ȼ���200 gϡ������ȷ�5�μ����ձ��У�ʣ������������±���ʾ��
���� | 1 | 2 | 3 | 4 | 5 |
ϡ����/�� | 40 | 40 | 40 | 40 | 40 |
ʣ�����/�� | 42 | 34 | 26 | 24 | 24 |
���� 5 �μ���ϡ���Ṳ�ռ������������Ϊ___________g��