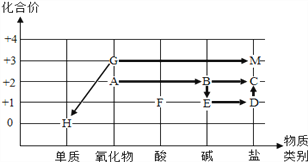
题目内容
【题目】某兴趣小组在准备化学实验基本技能考查时,对以下问题进行了探究.。
Ⅰ.探究酸和碱能否发生反应
方案 | 方案1 | 方案2 |
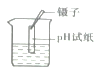
实验操作 及现象 | 甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液。由_______色变成无色。 | 乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了。 |
实验结论 | 酸和碱能发生反应 | 酸和碱能发生反应 |
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液;大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须___(填“小于”或“小于或等于”)7才能证明酸和碱能发生反应。请写出稀硫酸和氢氧化钠溶液反应的化学方程式_______
Ⅱ.探究酸和碱反应后溶液中溶质的成分
丙同学对Ⅰ中甲同学实验后的无色溶液展开探究。
【提出问题】试管中无色溶液的溶质除了酚酞还有什么?
【提出猜想】(l)Na2SO4 (2)Na2SO4和_____
【设计实验】
实验操作 | 实验现象 | 实验结论 | |
方案1 | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液。 | 锌粒逐渐减少,有____产生 | 猜想(2)成立 |
方案2 | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管。 | 开始无明显现象,过一会发现__________ |
【实验反思与拓展】
为了验证猜想(2)成立,你认为还可以选择的药品是_______(填字母序号)
A.BaCl2溶液 B.Cu C.CuO
【答案】 .红,; 小于或等于; ![]() ; .
; .![]() ; 产生无色气泡; 溶液由无色变成红色; C
; 产生无色气泡; 溶液由无色变成红色; C
【解析】(1)氢氧化钠显碱性,当加入酚酞时,溶液变红,当继续加入稀硫酸时,稀硫酸与氢氧化钠反应,当恰好完全反应时,溶液不显碱性,由红色变为无色;
(2)水稀释碱性溶液时,pH不能低于7 ,故pH小于或等于才能证明酸和碱能发生反应。;稀硫酸和氢氧化钠溶液反应的化学方程式为![]() ;
;
(3)试管中的溶液变为了无色,说明溶液中一定不含有氢氧化钠,一定含有生成的硫酸钠,可能含有过量的稀硫酸,故猜想2 是硫酸钠和硫酸;实验结论是有稀硫酸,故加入锌粒后有气泡冒出;当慢慢的加入氢氧化钠,开始无现象,一会儿变红,说明溶液中有过量的稀硫酸;硫酸和硫酸钠都可以与氯化钡反应生成沉淀,故不能鉴别,故A错误,铜与硫酸和硫酸钠都有不反应,故不可以鉴别,故B错误,氧化铜可以与硫酸反应溶液变为蓝色,而与硫酸钠不反应,故可以鉴别,故选C;

 挑战100单元检测试卷系列答案
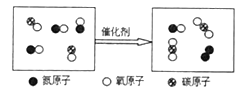
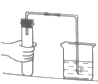
挑战100单元检测试卷系列答案【题目】(1)某化学兴趣小组利用如图所示装置进行实验,来研究工业炼铁的化学原理,试按要求填空:

①硬质玻璃管中观察到什么现象__________________
②写出一氧化碳和氧化铁反应的化学方程式______________________
③实验中首先通入一氧化碳的目的是什么________________________
(2)某反应在密闭容器中进行,测得反应前后各物质的质量如表,分析并回答问题:
物质 | 甲 | NH3 | CO2 | H2O |
反应前质量/g | 待测 | 0 | 0.1 | 0.2 |
反应后质量/g | 0 | 1.7 | 4.5 | 2.0 |
甲物质中一定含有__________种元素;该反应的基本反应类型________;反应中生成CO2和H2O的质量比为_______;甲物质可以做为_____肥料,为植物生长提供养分,促进植物茎、叶生长茂盛,叶色浓绿。
【题目】用下列实验操作可完成两个实验。请从A或B 两题中任选一个作答,若两题均作答,按A 计分。
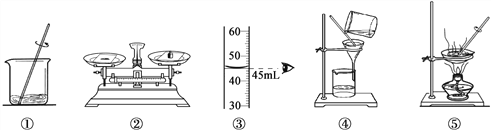
A去除粗盐中难溶性杂质 | B配制50g 10%的氯化钠溶液 |
(1)实验的操作步骤是___________(填序号)。 (2)实验中发现滤液浑浊,其原因是_____。 a.滤纸未贴紧漏斗内壁 b.滤纸破损 | (1)实验的操作步骤是____________(填序号)。 (2)实验后测得溶质质量分数<10%,其原因是_____。 a.装瓶时溶液洒出 b.烧杯中有水 |