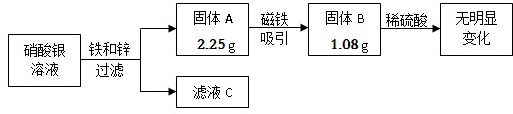
题目内容
在回收家电废品时,发现一种含铜和锌的合金.某化学兴趣小组的同学在测定样品中铜的含量时,取该样品25g放入烧杯中,向其中加入105g稀盐酸,恰好完全反应.反应后烧杯中剩余物的总质量为129.8g.请计算:
(1)反应产生氢气的质量是 g.
(2)求样品中铜的质量分数.(写出计算过程)
(1)0.2;(2)黄铜样品中铜的质量分数为74%.
解析试题分析:(1)根据质量守恒定律,产生氢气的质量为:25g+105g﹣129.8g=0.2g;
(2)设黄铜样品中锌的质量为x,
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.2g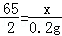 解得:x=6.5g
解得:x=6.5g
黄铜样品中铜的质量分数为: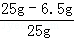 ×100%=74%
×100%=74%
考点:根据化学反应方程式的计算.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目