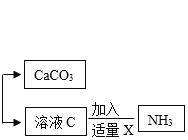
题目内容
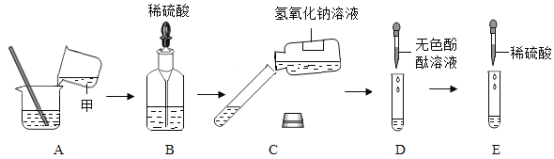
【题目】某化学兴趣小组同学将铜丝绕成螺旋状后,在酒精灯火焰上加热,铜丝变黑后,趁热插入疏松的氯化铵(NH4Cl)固体里,变黑的铜丝又变回紫红色。他们对此产生了兴趣,于是在老师的指导下进行如下探究:
(查阅资料)(1)氯化铵受热易分解,反应的化学方程式为:NH4Cl![]() NH3↑+HCl↑;
NH3↑+HCl↑;
(2)NH3+HCl=NH4Cl;
(3)无水硫酸铜为白色固体,遇水会变成蓝色。
(提出问题)使氧化铜还原为铜的是什么物质?
(作出猜想)猜想一:CO 猜想二:HCl 猜想三:NH3
小晶认为猜想一不合理,理由是_________。
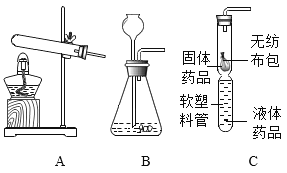
(实验探究)兴趣小组同学按如下装置进行实验(夹持装置已省略):
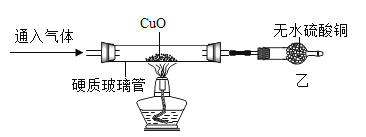
实验操作 | 实验现象 | 实验结论 |
将氯化氢气体和氨气分别通入装置,点燃酒精灯加热 | 通入氯化氢气体硬质玻璃管中无明显变化,通入氨气硬质玻璃管中观察到的现象是____。 | 猜想三成立 |
(反思与评价)
(1)通入氨气,观察到乙中固体变蓝,同时生成一种化学性质不活泼的气体。则氨气还原氧化铜的化学方程式为______。氨气有强烈的刺激性气味,对人体有害,则该装置存在的不足之处是________。
(2)小明认为实验室可用加热氯化铵的方法制取氨气,你认为该方法是否合理_________(填“合理”或“不合理”)。
(拓展延伸)“焊药”中含有氯化铵(NH4Cl),“焊药”的主要作用是清除焊接处金属表面生成的金属氧化物,确保焊接牢固。
【答案】不遵循质量守恒定律 黑色粉末逐渐变为红色(合理答案均可) ![]() 没有进行尾气处理 不合理
没有进行尾气处理 不合理
【解析】
[作出猜想]氧化铜和氯化铵中不含有碳元素,则使氧化铜还原为铜的物质不可能是一氧化碳,故小晶认为猜想一不合理,理由是不遵循质量守恒定律,反应物中不含碳元素。
[实验探究]实验结论为猜想三成立,故能使氧化铜还原为铜的是氨气,故通入氨气硬质玻璃管中观察到的现象是黑色粉末逐渐变为红色。
实验操作 | 实验现象 | 实验结论 |
将氯化氢气体和氨气分别通入装置,点燃酒精灯加热 | 通入氯化氢气体硬质玻璃管中无明显变化,通入氨气硬质玻璃管中观察到的现象是黑色粉末逐渐变为红色。 | 猜想三成立 |
[反思与评价]
(1)通入氨气,观察到乙中固体变蓝,说明生成水,同时生成一种化学性质不活泼的气体,根据质量守恒定律,化学反应前后,元素的种类不变,说明生成氮气。则氨气还原氧化铜的化学方程式为:![]() 。
。
氨气有强烈的刺激性气味,对人体有害,需要进行尾气处理,则该装置存在的不足之处是没有进行尾气处理。
(2)氯化铵加热生成氯化氢和氨气,生成两种气体,故实验室用加热氯化铵的方法制取氨气不合理。

 优加精卷系列答案
优加精卷系列答案【题目】沪教版九年级化学下册P197有下列表述:“在金属活动性顺序中,位于氢前面的金属能与酸反应置换出氢气”。
(提出问题)小明同学在阅读课本时提出问题,稀盐酸和浓盐酸反应是否相同?位于氢前面的金属能置换浓硫酸中的氢吗?于是他和同学们一起进行了实验探究。
(实验探究1)小明同学设计了下列实验方案,并记录了实验现象:
实验 | 固体药品 | 液体药品 | 现象 |
① | 铁片5g | 5%的盐酸25mL | 有无色无味的气体产生,反应速度较慢 |
② | 铁片5g | 37%的盐酸25mL | 有无色无味的气体产生,反应速度很快 |
(1)写出实验①中反应生成的盐的化学式是_____。
(2)上述实验设计的思想方法是_____。
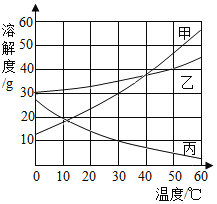
(3)经验证实验①和②产生的气体均为H2,由此小明同学得出位于氢前面的金属能置换出稀盐酸和浓盐酸中的氢;由上述实验还能得出的结论是_____。

(实验探究2)甲乙丙丁四位同学分别做了如上四个实验,观察现象,并进行对比。
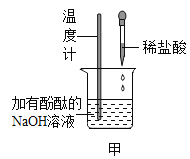
(1)甲同学观察有气泡产生,写出反应的化学方程式_____。
(2)乙同学的实验现象说明,浓度的改变也会影响物质的_____(填“化学”或“物理”)性质。
(3)丙同学实验时发现产生气泡的速度比甲同学快,说明升高_____能使反应加快。
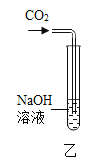
(4)丁同学实验时闻到有刺激性气味的气体产生。后经查阅资料和实验验证得知该气体是导致酸雨的主要物质,则该气体是_____(写化学式)。该实验说明,锌和浓硫酸在加热时能发生反应,反应类型_____(填“是”或“不是”)置换反应。
(评价反思)在探究酸的化学性质时,教材中的原话强调稀硫酸的原因是_____。